En la actualidad, debido a la importancia que ha adquirido lo «natural» y su vinculación con un estilo de vida saludable y la alimentación, se ha abierto un amplio mercado para un nuevo y variado grupo de productos con efectos positivos para la salud. Los consumidores se sienten atraídos por los denominados «productos naturales» y por aquellos con connotaciones sanitarias o de salud, pero no deben olvidar que una alimentación variada y equilibrada debe aportar todos los nutrientes necesarios para el normal desarrollo, mantenimiento y funcionamiento de un organismo sano1.
En el día a día, sin embargo, la complejidad de la alimentación, el modo de vida u otras razones pueden imposibilitar que las necesidades nutricionales sean alcanzadas debidamente, haciendo que en determinados momentos se opte por productos complementarios a la dieta. La mayoría de estos productos se venden bajo la categoría legal de «complemento alimenticio», y se caracterizan por contener compuestos específicos de un nutriente sin su base alimentaria, es decir, como la sustancia que alimenta sin el alimento en sí. Están destinados a completar la dieta normal, aportando de forma independiente los nutrientes que pueden o no encontrarse de forma suficiente en la alimentación ordinaria. Por su presentación y forma de dosificación son similares a los medicamentos, y se destinan a satisfacer necesidades nutricionales y fisiológicas de la población. Un complemento alimenticio nunca debe indicar en su etiquetado y presentación las propiedades de prevenir, tratar o curar patologías, puesto que son acciones exclusivas del medicamento. Existe una amplia gama de nutrientes y otros elementos que pueden estar presentes en su formulación, incluyendo, entre otros, las vitaminas (hidro y liposolubles) y minerales, así como los ácidos grasos, aminoácidos, fibras, probióticos y extractos de plantas.
Cada vez más es frecuente que los consumidores acudan a la farmacia para asesorarse sobre distintos tipos de complementos alimenticios, los cuales tienen una connotación de producto natural para nuestros clientes. Pero, ¿qué significa «natural»? Si leemos el etiquetado de estos productos, en la lista de ingredientes encontraremos todas las moléculas utilizadas, lo que es muy útil para saber hasta qué punto ese producto es «natural»: origen de la materia prima (natural o de síntesis); biodisponibilidad del nutriente (formas orgánicas, formas inorgánicas, liposomas, etc.); número y tipo de aditivos; tipo de material en contacto con el alimento, etc.
Según las últimas investigaciones, la ingesta de estos productos en países desarrollados se ha asociado a una mejor calidad de vida. También se ha observado que suelen recurrir a este tipo de productos las personas con estudios superiores, trabajos estables y un nivel socioeconómico alto, y que la mayoría de los consumidores suelen llevar una vida saludable. Además, se ha encontrado que el mayor consumo lo realizan mayoritariamente las mujeres2.
Es indispensable, por tanto, que el farmacéutico conozca la normativa básica de estos productos, generalmente presentados como «complementos alimenticios», y que sea capaz de valorar si el producto es de calidad, seguro y eficaz.
Marco legal de los complementos alimenticios. Situación actual
Los complementos alimenticios fueron regulados por primera vez en 2002 mediante la Directiva 2002/46/CE del Parlamento Europeo y del Consejo, de 10 de junio de 2002, relativa a la aproximación de las legislaciones de los Estados Miembros en materia de complementos alimenticios, y desde entonces no ha variado su definición:
«Los complementos alimenticios son aquellos productos cuyo fin sea complementar la dieta normal, consistentes en fuentes concentradas de nutrientes o de otras sustancias que tengan un efecto nutricional o fisiológico, en forma simple o combinada, comercializados en forma dosificada, es decir, cápsulas, pastillas, tabletas, píldoras y otras formas similares, bolsitas de polvos, ampollas de líquido, botellas con cuentagotas y otras formas similares de líquidos y polvos que deben tomarse en pequeñas cantidades unitarias».
Esta Directiva solo regula las vitaminas y minerales (Anexo I) y en determinadas formas químicas (Anexo II, modificado por el Reglamento 1170/2009), y, tal como se indica en el preámbulo, deja para una regulación posterior los otros tipos de nutrientes:
«Existe una amplia gama de nutrientes y otros elementos que pueden estar presentes en los complementos alimenticios, incluyendo, entre otros, las vitaminas, minerales, aminoácidos, ácidos grasos esenciales, fibras y diversas plantas y extractos de hierbas [...]. Conviene adoptar, en una fase posterior y una vez que se disponga de datos científicos adecuados al respecto, las normas específicas relativas a los nutrientes que no sean vitaminas o minerales, u otras sustancias con un efecto nutricional o fisiológico utilizadas como ingredientes de los complementos alimenticios».
Por ello, a escala europea solo están reguladas las vitaminas y los minerales, dejando, de momento, que las otras sustancias sean reguladas por cada Estado miembro3.
La transposición de la Directiva 2002/46/CE a nuestro ordenamiento jurídico se hizo un año más tarde, con la publicación del Real Decreto 1275/2003, referido a los complementos alimenticios. En un principio, esta publicación constituyó un primer paso largamente esperado por el sector que, hasta ese momento, vivía en una situación de ausencia de legalidad. Además, la demanda creciente de estos productos hacía imprescindible la ordenación del mercado. Dicho Real Decreto no fue una transposición fiel a la Directiva, pues se incluyeron límites máximos de vitaminas y minerales (el 100% de la cantidad diaria recomendada, actualmente llamado «valor nutricional de referencia») que no estaban incluidos en la directiva europea, aunque ésta los preveía (hasta la fecha no se han establecido). Finalmente, en 2009 se derogó y se publicó el vigente Real Decreto 1487/2009 relativo a los complementos alimenticios, que ha sido modificado en 2018 con la inclusión de un nuevo anexo III con otras sustancias que pueden ser utilizadas en la fabricación de estos productos4.
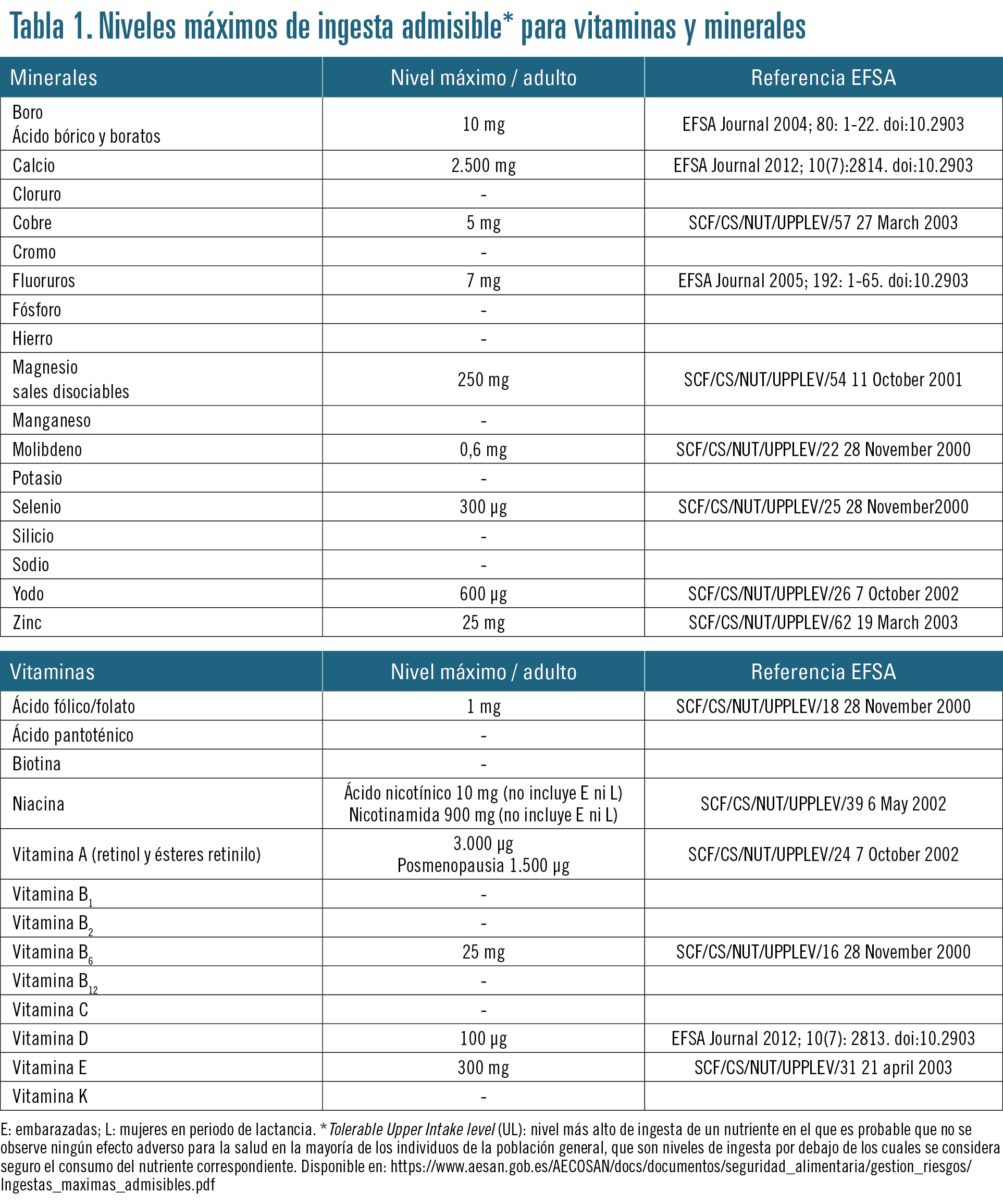
Para proteger al consumidor de un consumo excesivo de vitaminas y minerales, y puesto que sus niveles máximos no se han establecido a escala europea, la Agencia Española de Seguridad Alimentaria y Nutrición (AESAN) publica en su página web, en la sección de complementos alimenticios, una tabla resumen de los niveles máximos de ingesta admisible (upper level) establecidos por la European Food Safety Authority (EFSA). Dichos niveles se refieren a la ingesta diaria de cada uno de ellos (vitaminas y minerales), teniendo en cuenta todas las fuentes de la dieta. Se entiende, por tanto, que la cantidad presente en esta tabla (tabla 1) es el nivel máximo que un complemento alimenticio puede llevar en su formulación para la dosis diaria recomendada.
Así pues, la situación legal de estos productos en Europa, y sobre todo en España, ha cambiado bastante en los últimos 20 años, ya que ha pasado de tener un marco legal poco definido a tener una normativa específica que incluso permite el reconocimiento mutuo para la libre circulación de mercancías.
A los complementos alimenticios, además de la normativa específica que los regula, se les aplica la totalidad de la extensa legislación alimentaria: aditivos, colorantes, edulcorantes, materiales en contacto con los alimentos, higiene alimentaria, nuevos alimentos, aromas, enzimas, organismos modificados genéticamente, criterios microbiológicos, residuos de plaguicidas, contaminantes, control oficial, etiquetado, presentación y publicidad, declaraciones nutricionales y de propiedades saludables, información al consumidor, identificación de lotes, y un largo etcétera de normas que no dejan nada al azar.
Complementos alimenticios a base de arroz de levadura roja: novedades
En los últimos años ha crecido la preocupación por la presencia de «contaminantes» en estos productos. Una de las últimas normativas aprobadas relacionada con los ingredientes que forman parte de los complementos ha sido el Reglamento 2019/1901 de la Comisión, por el que se modifica el Reglamento (CE) n.º 1881/2006 concerniente a los contenidos máximos de citrinina en complementos alimenticios a base de arroz fermentado con levadura roja Monascus purpureus (monakolina K). En 2006, el contenido máximo de citrinina, micotoxina que puede aparecer durante el proceso de la fermentación, se limitó a 2.000 µg/kg, pero debido a los nuevos datos científicos que se iban publicando y a la incertidumbre referente a su toxicidad, se revisó el contenido máximo, bajando los niveles a 100 µg/kg. Por tanto, todos los complementos alimenticios que contengan esta sustancia deben cumplir con estos límites máximos. Y es que el arroz fermentado con levadura roja (fuente de monakolina K) no es la primera vez que genera controversia. Actualmente, la Comisión Europea está debatiendo limitar su consumo con una dosis máxima diaria muy inferior a los 10 mg de monacolina K y, posiblemente, en 2021 veremos publicado un Reglamento con esta restricción. Será un periodo de cambios, puesto que la alegación actualmente vigente («La monacolina K del arroz de levadura roja contribuye a mantener niveles normales de colesterol sanguíneo») solo puede utilizarse para aquellos complementos que aporten una ingesta diaria de 10 mg de monacolina K del arroz de levadura roja. La industria alimentaria es conocedora de la problemática, pero debe esperar a que la Comisión Europea se pronuncie para poder efectuar los cambios necesarios tanto en formulación como en etiquetado.
¿Se puede utilizar el término «probiótico» en los complementos alimenticios?
Según el documento Principios generales de flexibilidad en la redacción de declaraciones de propiedades saludables, publicado en 2012, se entendía la palabra probiótico como una alegación de salud no autorizada. A finales del pasado mes de febrero la AESAN publicó en su página web dos documentos interpretativos sobre la palabra probiótico donde especificaba que en el etiquetado, presentación y publicidad de un alimento (y complemento alimenticio), el término «probiótico», el «nombre de un microorganismo» o sus «siglas» fuera de la lista de ingredientes tienen el mismo significado para el consumidor y, por tanto, se consideran en todos los casos una declaración de propiedades saludables. Concretamente, se consideran una declaración de salud inespecífica, que solamente podría ser usada en combinación con una declaración de propiedades saludables específica autorizada para el microorganismo presente en el alimento (actualmente solo hay la alegación de los cultivos vivos del yogur con un contenido mínimo de 108 UFC). Sin embargo, el pasado 27 de octubre de 2020 la nota interpretativa se ha modificado indicando lo siguiente:
«En el ámbito de los complementos alimenticios, se ha comprobado que hay un gran número de complementos alimenticios en el mercado en los que figura el término “probiótico/s”. Estos productos proceden de diferentes países de la UE, donde se les permite la comercialización con esta denominación y, por lo tanto, no se les podría impedir su comercialización en España, en aplicación del “principio de reconocimiento mutuo” establecido en el Tratado de la Unión Europea.
En consecuencia, teniendo en cuenta lo citado anteriormente, y hasta tanto no haya un criterio uniforme por parte de los Estados miembros de la Unión Europea, se considera que podría aceptarse que figure el término “probiótico/s” en la etiqueta de los productos alimenticios, tanto de fabricación nacional como de otros países de la Unión Europea.»
Por tanto, actualmente se acepta el uso del término probiótico en el etiquetado de los complementos alimenticios, tanto de fabricación nacional como de otros países de la UE sin acompañarlo de una alegación de salud.
Cabe recordar que, aunque a priori los productos naturales puedan parecer complementos alimenticios, según cómo se presenten al consumidor, y según las alegaciones e indicaciones y tipo de registro realizado, podemos encontrar un mismo ingrediente como complemento o como medicamento. Por ejemplo, un producto a base de cúrcuma se puede vender como especie culinaria, como un preparado para infusión (solo o con mezclas de otras plantas o especies), como complemento alimenticio o incluso como medicamento. El medicamento podrá alegar que es para el tratamiento de trastornos funcionales digestivos de origen hepaticobiliar5, mientras que un complemento o alimento no.
El dilema inmediato al que hoy se enfrenta el farmacéutico con los productos naturales radica en establecer lo que realmente funciona y lo que no. Determinar la calidad, seguridad y eficacia verdadera de un producto natural es difícil, pero leyendo bien el etiquetado (figura 1) podemos obtener una información muy válida en la que basar nuestro criterio. Los farmacéuticos somos conocedores del consumo de estos productos por la población (o por parte de la población), pero sabemos que aún existe poco conocimiento y juicio sobre ellos. Por mucho que se los considere «naturales», eso no implica que sean inocuos, de modo que debemos investigar los posibles efectos adversos y las posibles interacciones farmacológicas.
Bibliografía
1. García-Castrillón C, Verschuur F. La problemática regulación comunitaria de los complementos alimenticios. Información Comercial Española, ICE. Revista de economía. 2007; 836: 163-183.
2. Mejía F, Camacho M, García A, Monterrubio E, Shamah T, Vilalpando S. Factores asociados al uso de suplementos alimenticios en mujeres mexicanas de 12 a 49 años de edad. ALAN. 2008; 58(2): 164-173.
3. Informe de la Comisión al Consejo y Parlamento Europeo sobre la utilización de sustancias distintas de las vitaminas y los minerales en los complementos alimenticios. SEC (2008) 2976, SEC (2008) 2977.
4. Real Decreto 130/2018, de 16 de marzo, por el que se modifica el Real decreto 1487/2009, de 26 de septiembre, relativo a los complementos alimenticios. Disponible en: https://www.boe.es/diario_boe/txt.php?id=BOE-A-2018-4245
5. Ficha técnica Extracto de cúrcuma Centrum 100 mg comprimidos. Extracto seco de rizoma de Curcuma longa L. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/64783/FT_64783.pdf
6. Reglamento (UE) n.º 1169/2011 del Parlamento Europeo y del Consejo de 25 de octubre de 2011 sobre la información alimentaria facilitada al consumidor, por el que se modifican los Reglamentos (CE) n.º 1924/2006 y (CE) n.º 1925/2006 del Parlamento Europeo y del Consejo, y por el que se derogan la Directiva 87/250/CEE de la Comisión, la Directiva 90/496/CEE del Consejo, la Directiva 1999/10/CE de la Comisión, la Directiva 2000/13/CE del Parlamento Europeo y del Consejo, las Directivas 2002/67/CE y 2008/5/CE de la Comisión, y el Reglamento (CE) n.º 608/2004 de la Comisión.
7. Reglamento (CE) n.º 1924/2006 del Parlamento Europeo y del Consejo de 20 de diciembre de 2006, relativo a las declaraciones nutricionales y de propiedades saludables en los alimentos.
8. Reglamento (UE) n.º 432/2012 de la Comisión, de 16 de mayo de 2012, por el que se establece una lista de declaraciones autorizadas de propiedades saludables de los alimentos distintas de las relativas a la reducción del riesgo de enfermedad y al desarrollo y la salud de los niños. Disponible en: https://www.aesan.gob.es/AECOSAN/web/seguridad_alimentaria/detalle/declaraciones_nutricionales_saludables.htm