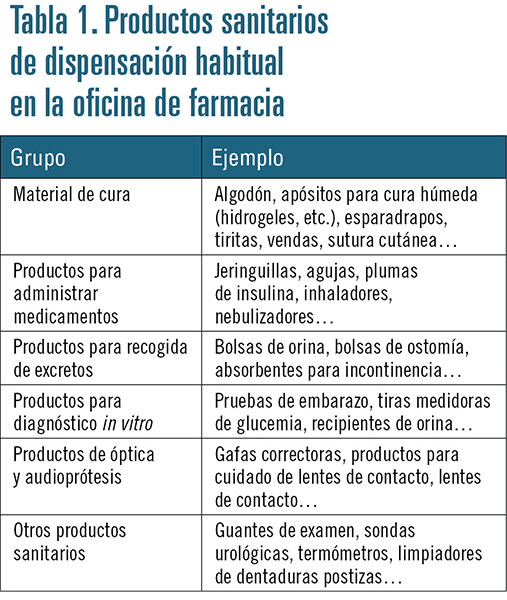
 Los productos sanitarios representan una parte significativa y en crecimiento de los productos que se dispensan en una oficina de farmacia. Son muchos los ejemplos de productos de este tipo que se pueden encontrar en una oficina de farmacia, desde algodón a sutura cutánea, jeringuillas, inhaladores, bolsas de orina, pruebas de embarazo, gafas correctoras, sondas… (tabla 1). En este sentido, es importante que el farmacéutico tenga una formación adecuada para poder aconsejar al paciente sobre la correcta utilización de estos productos, pero también que asuma la responsabilidad de cumplir con el sistema de vigilancia de productos sanitarios, para evitar que un incidente conocido relacionado con un producto de este tipo pueda producir daños a otros pacientes.
Los productos sanitarios representan una parte significativa y en crecimiento de los productos que se dispensan en una oficina de farmacia. Son muchos los ejemplos de productos de este tipo que se pueden encontrar en una oficina de farmacia, desde algodón a sutura cutánea, jeringuillas, inhaladores, bolsas de orina, pruebas de embarazo, gafas correctoras, sondas… (tabla 1). En este sentido, es importante que el farmacéutico tenga una formación adecuada para poder aconsejar al paciente sobre la correcta utilización de estos productos, pero también que asuma la responsabilidad de cumplir con el sistema de vigilancia de productos sanitarios, para evitar que un incidente conocido relacionado con un producto de este tipo pueda producir daños a otros pacientes.
Por ello, aun cuando la oficina de farmacia no sea el establecimiento exclusivo de venta de productos sanitarios, el farmacéutico debe garantizar y mejorar la atención al paciente o usuario, y asumir la filosofía del uso racional de los medicamentos y las funciones de vigilancia de los posibles efectos adversos de todos los productos sanitarios que venda en su farmacia. El hecho de que las oficinas de farmacia cubran prácticamente la totalidad del territorio español permite que los farmacéuticos estén en disposición de hacer llegar a la mayoría de la población cualquier información relacionada con un producto sanitario. En los últimos años, se ha desarrollado una normativa sobre productos sanitarios (tabla 2) en la que se establecen las directrices sobre el sistema de vigilancia de estos productos. Aun así, en ella no se articula ni regula específicamente para las oficinas de farmacia, quedando por tanto una parte de la población en riesgo de sufrir algún incidente adverso al ser posible que no reciba a tiempo información sobre cualquier alerta relacionada con un producto sanitario.
En los últimos años, se ha desarrollado una normativa sobre productos sanitarios (tabla 2) en la que se establecen las directrices sobre el sistema de vigilancia de estos productos. Aun así, en ella no se articula ni regula específicamente para las oficinas de farmacia, quedando por tanto una parte de la población en riesgo de sufrir algún incidente adverso al ser posible que no reciba a tiempo información sobre cualquier alerta relacionada con un producto sanitario.
El sistema de vigilancia de estos productos se refiere a la notificación de los incidentes adversos, a su registro y evaluación, a la adopción de las medidas oportunas para la prevención de la salud de los pacientes y a la transmisión de estas medidas a los agentes interesados. El ámbito del sistema de vigilancia de productos sanitarios incluye los productos considerados como tales (p. ej., los productos para diagnóstico in vitro, y accesorios), tanto aquellos con marcado CE como aquellos que no lo precisan (productos sanitarios fabricados a medida o destinados a investigaciones).
Según el Artículo 42 del Real Decreto (RD) 1591/2009, los profesionales sanitarios tienen la responsabilidad de notificar los incidentes adversos acaecidos con los productos sanitarios. Se considera un incidente adverso «cualquier funcionamiento defectuoso, fallo o deterioro de las características o del funcionamiento de un producto, así como cualquier deficiencia en el etiquetado o en las instrucciones de utilización que pueda o haya podido dar lugar a la muerte o al deterioro grave del estado de salud de un paciente o usuario». Deben notificarse, por tanto, todos aquellos casos en los que esté implicado un producto sanitario:
• Situaciones en las que el uso del producto haya causado la muerte.
• Casos en los que haya causado un grave deterioro en la salud del paciente, usuario u otra persona, o bien si se considera que pueda causarlos.
• Procesos en los que es precisa una intervención médica o quirúrgica para evitar el deterioro permanente de una función corporal o el daño permanente de una estructura corporal.
• Incidentes potenciales, es decir, aquellos que podrían haber dado lugar a la muerte o a un grave deterioro de la salud, pero que no se han producido debido a circunstancias afortunadas o a la intervención del personal sanitario.
El principal objetivo del sistema de vigilancia de productos sanitarios es mejorar la protección de la salud y la seguridad de los pacientes, usuarios y otros agentes, al reducir la probabilidad de que vuelvan a repetirse los incidentes en otros lugares. Para ello, es necesario evaluar los incidentes notificados y difundir la información que ayude a prevenir estos incidentes o a mitigar sus consecuencias. Se pretende por tanto facilitar la aplicación directa, temprana y armonizada de las acciones correctivas de seguridad en este ámbito.
En el caso de la oficina de farmacia, el papel del responsable de vigilancia no está definido legalmente, pero actuaría como tal el farmacéutico titular o la persona en quien delegue, teniendo siempre el primero la responsabilidad legal final. Además, para un correcto funcionamiento del sistema es necesaria la implicación activa de los colegios de farmacéuticos, a través de los centros de información del medicamento o departamentos en los que recaiga la responsabilidad relacionada con la farmacovigilancia y vigilancia de productos sanitarios.
Tenemos, por tanto, dos situaciones básicas: la comunicación de un incidente adverso por parte de un paciente, y la recepción de una alerta por parte de un farmacéutico. A continuación describimos los aspectos básicos y las acciones que deben llevarse a cabo para poder participar del sistema de vigilancia de productos sanitarios.
Caso práctico
Paciente que acude a la oficina de farmacia a comunicar un incidente relacionado con un producto sanitario
En esta situación, independientemente de si el producto sanitario se ha dispensado en nuestra oficina de farmacia o en otra, debemos atender al paciente y recoger la siguiente información:
• Nombre, datos de contacto y edad del paciente.
• Producto implicado: tipo de producto, nombre comercial, lote o número de serie (si es posible), distribuidor, etc.
• Datos del incidente: fecha, descripción, medidas adoptadas, consecuencias para el paciente.
En los anexos bibliográficos se muestran los modelos que deben cumplimentarse para notificar el incidente, debiendo indicar si el producto se ha podido recuperar y si está custodiado en la oficina de farmacia, o si el paciente lo ha desechado y no es posible recuperarlo. Sea como sea, debe notificarse el incidente a la autoridad competente, en este caso al punto de vigilancia de productos sanitarios de cada comunidad autónoma (véanse anexos bibliográficos).
Puede ser de utilidad disponer de alguna base de datos donde registrar esta información para realizar el seguimiento del incidente, y además ello ayudará a fidelizar al paciente, al observar que desde la farmacia se le está prestando un servicio básico para mejorar su seguridad en el uso de un producto sanitario.
Un ejemplo práctico es el incidente relacionado con una solución hidroalcohólica recibida en una farmacia en la que se observa un defecto que provoca que la solución antiséptica se pierda a través de la junta de la válvula de dispensación. En este caso, el envase no presentaba la adecuada estanqueidad, y existía riesgo de contaminación microbiológica de la solución.
Otro ejemplo podría ser la comunicación por parte de un paciente con alergia al látex de una erupción en la zona de colocación de un esparadrapo con soporte de tejido no tejido, y en el que se indica que no contiene látex. Ante esta situación, deberemos cumplimentar el anexo 3 para remitirlo al punto autonómico de vigilancia de productos sanitarios, y registrarlo en una base de datos similar a SIVIPS® para el correcto seguimiento del incidente.
 Recepción de una alerta relacionada con un producto sanitario
Recepción de una alerta relacionada con un producto sanitario
Las alertas relacionadas con productos sanitarios deben remitirse también a las oficinas de farmacia, de modo que el farmacéutico pueda aconsejar a la población que demande información sobre esta alerta, y comprobar si dispone de este producto sanitario o si lo ha dispensado a algún paciente. En este punto, es clave conocer una serie de términos (tabla 3) para poder entender la información que se presenta en la alerta.
Las «acciones correctivas de seguridad en campo» (FSCA, por sus siglas en inglés) pueden incluir la devolución del producto sanitario al suministrador, su modificación, el cambio de éste por otro, o su destrucción. También puede producirse la adaptación del producto por el comprador según la modificación o cambio de diseño efectuado por el fabricante, o incluso según las recomendaciones del fabricante en cuanto a su uso (por ejemplo, cuando un producto haya dejado de comercializarse o se haya retirado del mercado, y que aún podrían estar utilizando algunos usuarios, como en el caso de los implantes, o en el caso de los cambios en la sensibilidad analítica o especificidad de los productos sanitarios para diagnóstico).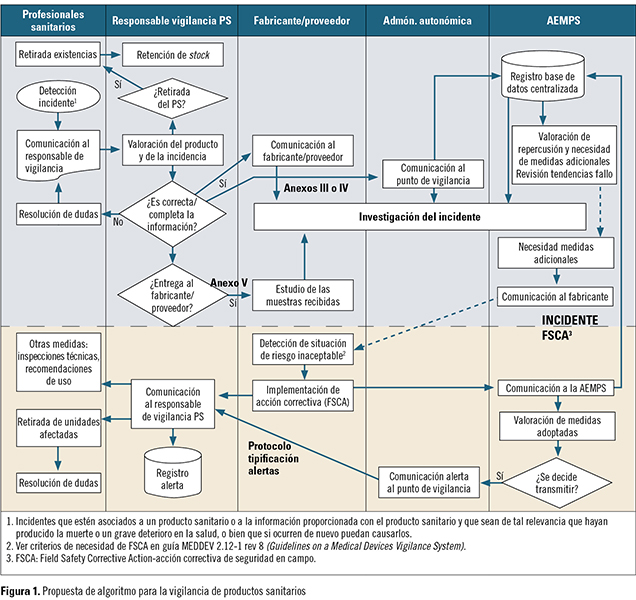 El Grupo de Productos Sanitarios de la SEFH publicó unas recomendaciones para poder cumplir con el sistema de vigilancia. En la figura 1 se muestra un algoritmo de actuación para la comunicación de cualquier incidente relacionado con un producto sanitario, así como las medidas que deben tomarse y las acciones que deben seguirse ante la recepción de una alerta comunicada por los organismos competentes en materia de sanidad.
El Grupo de Productos Sanitarios de la SEFH publicó unas recomendaciones para poder cumplir con el sistema de vigilancia. En la figura 1 se muestra un algoritmo de actuación para la comunicación de cualquier incidente relacionado con un producto sanitario, así como las medidas que deben tomarse y las acciones que deben seguirse ante la recepción de una alerta comunicada por los organismos competentes en materia de sanidad.
De esta forma, el farmacéutico de oficina de farmacia podrá establecer una relación directa con la Administración en materia de vigilancia de productos sanitarios, y mejorar la calidad de su servicio y la seguridad del paciente, permitiendo además a la Administración disponer de información sobre posibles incidentes con los productos sanitarios dispensados, de modo que sea posible adoptar acciones correctivas que permitan reducir el impacto de cualquier incidente sobre la salud de la población.
Los tipos de alertas que pueden recibirse son:
• Las relacionadas con problemas de calidad:
– Clase I. Derivadas de defectos en el producto sanitario que causen peligro para la vida. Son comunicadas inmediatamente.
– Clase II. Defectos que pueden producir daño, pero no vital. Hay que actuar rápido, en 24 horas.
– Clase III. Los defectos no son graves a priori para la salud. Debe comunicarse la alerta cuanto antes.
• Las relacionadas con problemas de seguridad que pueden obligar a la suspensión de la comercialización de forma temporal o definitiva. En ocasiones no es necesario tomar medidas tan rigurosas, y es suficiente con remitir notas informativas.
Un ejemplo de incidente es el de la notificación de la retirada del mercado de los glucómetros OneTouch® Verio® PRO y OneTouch® Verio® IQ, el 26 de marzo de 2013, ante el riesgo de obtener resultados incorrectos o fallo al proporcionar un aviso de concentraciones extremadamente altas de glucosa en sangre. En este caso, se remitió una alerta con instrucciones claras para las oficinas de farmacia, como comprobar si tenían glucómetros de este tipo en depósito, devolver las existencias que pudieran tener en el almacén, e informar a los pacientes que utilizaban estos glucómetros. En este último caso, era necesaria una correcta trazabilidad para poder identificar a los pacientes a quienes se les dispensó alguno de estos productos. Por tanto, es necesario disponer de una pequeña base de datos con información básica del paciente y del producto (denominación, número de serie…), ya que ello ayudaría a la identificación rápida de los pacientes en riesgo.
Otros ejemplos son aquellas alertas relacionadas con sillas de ruedas, grúas para pacientes encamados, etc., que pudieran haberse dispensado en oficinas de farmacia con sección de ortopedia. Al igual que en el caso anterior, la trazabilidad del producto dispensado permitiría la identificación de los pacientes en riesgo.
Conclusiones
El papel del farmacéutico en la oficina de farmacia como un integrante más del sistema de vigilancia de productos sanitarios es clave, tanto por su cercanía al paciente como por el ámbito de actuación tan amplio de que dispone. De esta forma, se cumple una de las funciones del farmacéutico que se establece en la Ley 44/2003, de Ordenación de las Profesiones Sanitarias, como es la vigilancia de salud pública, sobre todo en materia de medicamentos y productos sanitarios.
No obstante, es preciso regular y dotar de más medios e información a las oficinas de farmacia, de modo que éstas puedan incrementar su efectividad en el sistema de vigilancia de productos sanitarios, sobre todo en lo concerniente a la difusión a sus pacientes de las alertas que se reciben.
Anexos
Enlaces a los documentos y puntos de vigilancia de productos sanitarios.
Anexo 1. Formulario de notificación de incidentes por los profesionales sanitarios (excepto para productos sanitarios de diagnóstico in vitro). Disponible en: http://www.aemps.gob.es/vigilancia/productosSanitarios/docs/anexo3-vig-prof.doc
Anexo 2. Formulario de notificación de incidentes por los profesionales sanitarios para productos sanitarios de diagnóstico in vitro. Disponible en: http://www.aemps.gob.es/vigilancia/productosSanitarios/docs/anexo4-vig-prof.doc
Anexo 3. Directorio de puntos de vigilancia de productos sanitarios. Disponible en: http://www.aemps.gob.es/vigilancia/productosSanitarios/docs/anexo7-puntosVigilancia.pdf
Bibliografía
Abad Luna C, Cantalapiedra Sanjos M.ªJ. Productos Sanitarios: Aspectos Legales y Perspectivas de futuro.
AEMPS/CTI-PS/Octubre 2010. Puntos de Vigilancia de Productos Sanitarios
Buenas prácticas de Farmacovigilancia del Sistema Español de Farmacovigilancia.
Directrices sobre el sistema de vigilancia de productos sanitarios. Madrid: Ministerio de Sanidad y Consumo, 2008.
Gaspar Carreño M, Márquez Peiró JF, Arias P, Arranz T, Selva Otaolaurruchi J, Marco JL, en representación del Grupo de Productos Sanitarios de la SEFH. Recomendaciones para la vigilancia de productos sanitarios por los centros/hospitales y los profesionales sanitarios. Panorama Actual del Medicamento. 2014; 38(374): 555-560.
Ley 29/2006, de Garantías y Uso Racional de Medicamentos y Productos Sanitarios.
Muelas Tirado JA. Aspectos prácticos de la vigilancia de medicamentos y productos sanitarios. 53º Congreso Nacional de la SEFH. Valencia, octubre 2008.
Real Decreto 1616/2009, de 26 octubre, por el que se regulan los productos sanitarios implantables activos.
Real Decreto 1591/2009, de 16 de octubre, por el que se regulan los producto sanitarios.
Real Decreto 1662/2000, de 29 de septiembre, sobre productos sanitarios para diagnóstico in vitro.
Real Decreto 1144/2007. Farmacovigilancia de Medicamentos de Uso Humano.
Selva J, Márquez J. Vigilancia de Productos Sanitarios: Perspectiva Hospitalaria. 56º Congreso Nacional de la SEFH. Santiago de Compostela, octubre 2011.
