La seguridad de uso de los medicamentos en los niños puede verse comprometida por diversas causas. A lo largo del tiempo este hecho ha sido un motivo de preocupación para las administraciones sanitarias de los distintos países y el debate suscitado llevó a la OMS, en 2007, a publicar el documento Promover la Seguridad de los Medicamentos para Niños1. En aquella publicación se revisaban los principales factores que pueden incidir en esa seguridad como: las características fisiológicas de la población pediátrica, las formulaciones y presentaciones disponibles, la necesidad de más estudios de investigación pre y postcomercialización, el marco legal, etc. Y, en lo que se refiere en particular a medicamentos que no requieren prescripción médica, tradicionales y remedios a base de plantas, alertaba que a menudo su uso no está basado en evidencias y puede ser inadecuado.
En relación con este último tema, hace algunos días saltaba a distintos medios de comunicación un titular que hacía referencia a que la Agencia Europea del Medicamento (EMA) había «certificado» las plantas medicinales para niños y elaborado un documento de recomendaciones de uso de los preparados farmacéuticos a base de plantas en esta población. La noticia llevaba un enlace al documento de la EMA «HMPC monographs: Overview of recommendations for the uses of herbal medicinal products in the paediatric population», publicado el pasado mes de mayo por el Comité de productos a base de plantas medicinales2. Este documento no constituye en realidad ninguna certificación, su  propósito, como indica en su introducción, es proporcionar una visión general de las recomendaciones para el uso de los preparados a base de plantas en la población pediátrica, según lo establecido en las monografías elaboradas y publicadas. Se destaca en el mismo que como el rango de edad y el uso de medicamentos a base de plantas –dentro de esta población especial de pacientes– son discutidos con frecuencia por los profesionales de la salud, se hace necesario proporcionar un resumen de la información de las monografías para facilitar la referencia. En el mismo, se listan las plantas resumiendo las indicaciones y las limitaciones de uso en los niños, según la evaluación del mencionado Comité.
propósito, como indica en su introducción, es proporcionar una visión general de las recomendaciones para el uso de los preparados a base de plantas en la población pediátrica, según lo establecido en las monografías elaboradas y publicadas. Se destaca en el mismo que como el rango de edad y el uso de medicamentos a base de plantas –dentro de esta población especial de pacientes– son discutidos con frecuencia por los profesionales de la salud, se hace necesario proporcionar un resumen de la información de las monografías para facilitar la referencia. En el mismo, se listan las plantas resumiendo las indicaciones y las limitaciones de uso en los niños, según la evaluación del mencionado Comité.
En el propio documento se especifica que la lista se refiere a sustancias y preparaciones específicas tal como se mencionan en las monografías Comunitarias que se publican como base para el registro simplificado de Medicamentos Tradicionales a base de Plantas (MTP) o para la categoría de medicamentos de uso bien establecido y no a otras categorías de productos naturales como suplementos alimenticios o alimentos.
Dos grupos de productos
El listado se divide en dos grupos de productos a base de plantas. Un grupo recoge aquellas drogas vegetales (con sus productos de extracción) cuya autorización de comercialización se puede amparar bajo el estatus de medicamento de «uso bien establecido» por contar con suficientes datos de seguridad y eficacia. El segundo grupo recoge aquellas sustancias vegetales (con sus productos de extracción) cuyo uso tradicional (registro simplificado de Medicamento Tradicional a base de Plantas = MTP) se acepta sobre la base de datos de seguridad suficiente y eficacia plausible.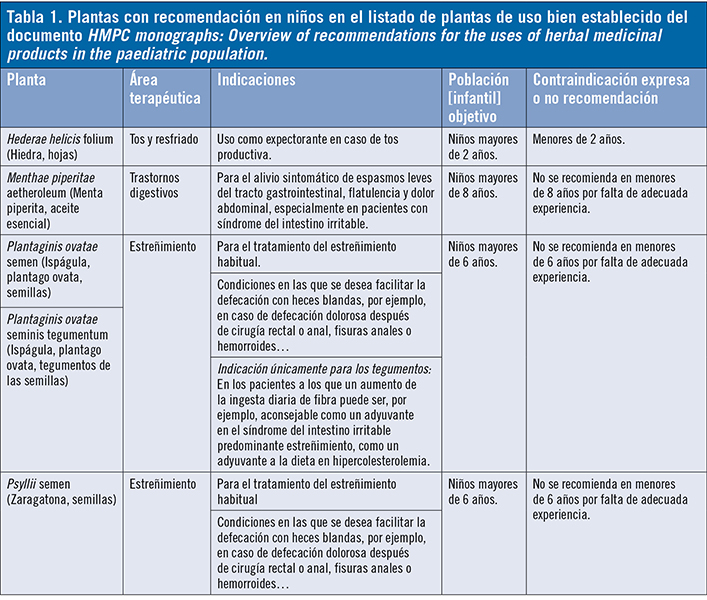 De las 22 drogas vegetales listadas en «uso bien establecido» solo 5 recogen indicaciones para niños indicando el rango de edad a partir del cual se pueden usar: las hojas de hiedra (Hederae helicis folium) para el área terapéutica de tos y resfriado, para mayores de 2 años; el aceite esencial de menta piperita (Menthae piperitae aetheroleum) para el área digestiva, para niños mayores de 8 años; y las semillas y tegumentos de ispágula (Plantaginis ovatae semen) y la zaragatona (Psyllii semen) para el área del estreñimiento, en mayores de 6 años. Todas ellas en uso oral. Para 9 drogas vegetales se recoge su uso a partir de la adolescencia (12 años) y para el resto no se recomienda su uso más que en la edad adulta. El mayor porcentaje de causas de no recomendación (≈59%) es la «falta de datos adecuados o experiencia suficiente».
De las 22 drogas vegetales listadas en «uso bien establecido» solo 5 recogen indicaciones para niños indicando el rango de edad a partir del cual se pueden usar: las hojas de hiedra (Hederae helicis folium) para el área terapéutica de tos y resfriado, para mayores de 2 años; el aceite esencial de menta piperita (Menthae piperitae aetheroleum) para el área digestiva, para niños mayores de 8 años; y las semillas y tegumentos de ispágula (Plantaginis ovatae semen) y la zaragatona (Psyllii semen) para el área del estreñimiento, en mayores de 6 años. Todas ellas en uso oral. Para 9 drogas vegetales se recoge su uso a partir de la adolescencia (12 años) y para el resto no se recomienda su uso más que en la edad adulta. El mayor porcentaje de causas de no recomendación (≈59%) es la «falta de datos adecuados o experiencia suficiente».
Otras causas son: indicación o uso no relevante en esa categoría de edad; contraindicación expresa (9) o necesidad de supervisión médica (tabla 1). En cuanto al listado de uso tradicional debe significarse que las monografías se muestran muy restrictivas respecto a su uso en niños debido, entre otras causas, a que los productos que se comercialicen al amparo del registro simplificado de MTP, como recoge la Directiva 2004/24/CE3, han de tener indicaciones apropiadas exclusivamente para medicamentos tradicionales a base de plantas que, por su composición y finalidad, estén destinados y concebidos para su utilización sin el control de un facultativo médico a efectos de diagnóstico o de prescripción o seguimiento de un tratamiento. La información, en cuanto a indicaciones y uso, es la misma que se reflejará en la información al público del medicamento, por lo que dado que van a poder ser utilizados en autocuidado y la población pediátrica es especialmente vulnerable, es lógico que solo se indiquen en niños para aquellas drogas vegetales que hayan demostrado un alto nivel de seguridad para la finalidad a la que van destinadas.
En cuanto al listado de uso tradicional debe significarse que las monografías se muestran muy restrictivas respecto a su uso en niños debido, entre otras causas, a que los productos que se comercialicen al amparo del registro simplificado de MTP, como recoge la Directiva 2004/24/CE3, han de tener indicaciones apropiadas exclusivamente para medicamentos tradicionales a base de plantas que, por su composición y finalidad, estén destinados y concebidos para su utilización sin el control de un facultativo médico a efectos de diagnóstico o de prescripción o seguimiento de un tratamiento. La información, en cuanto a indicaciones y uso, es la misma que se reflejará en la información al público del medicamento, por lo que dado que van a poder ser utilizados en autocuidado y la población pediátrica es especialmente vulnerable, es lógico que solo se indiquen en niños para aquellas drogas vegetales que hayan demostrado un alto nivel de seguridad para la finalidad a la que van destinadas.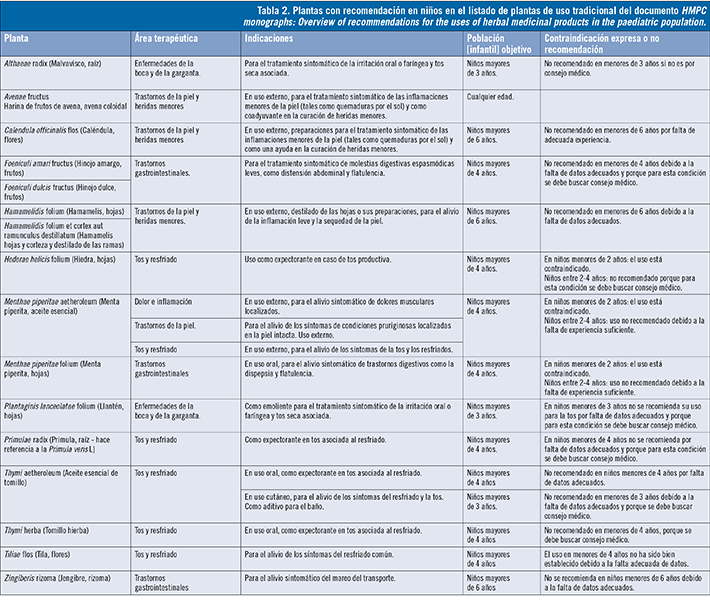
Para las 94 drogas vegetales listadas se recogen un total de 171 indicaciones (57 drogas con más de una indicación). De entre todas ellas solo se recogen indicaciones para niños en 16 drogas vegetales, haciendo constar el rango de edad a partir del cual pueden ser utilizadas. Del total de 16 indicaciones 9 son para uso oral y 7 para uso tópico (tabla 2). Las principales áreas de recomendación son: tos y resfriado, trastornos gastrointestinales y trastornos de la piel. Se recogen asimismo un total de 67 indicaciones para 40 drogas vegetales que pueden ser usadas a partir de la adolescencia (12 años). Como en el caso anterior, el mayor porcentaje de causas de no recomendación es la «falta de datos adecuados o experiencia suficiente», repitiéndose de la misma forma el resto de causas (indicación o uso no relevante en la categoría de edad; contraindicación expresa o necesidad de supervisión médica).
Teniendo en cuenta que, según una encuesta realizada en España, en 2011, por INFITO (Centro de Investigación sobre Fitoterapia), entre 630 pediatras, un 68% de ellos declaró recomendar preparados a base de plantas medicinales y haber percibido un creciente interés de los padres por los tratamientos naturales, no hay duda de que este documento establece unas bases que permitirán a los profesionales de la salud resolver dudas y recomendar estos preparados con mayor seguridad. Sin embargo, no debe olvidarse que aún a falta de estudios concretos en la población infantil, la seguridad de uso y la eficacia de muchas plantas de uso tradicional en niños viene avalada precisamente por los largos años de uso sin que ello venga recogido en las monografías y listas hasta el momento publicadas. Como es lógico el conocimiento de las mismas por parte del profesional de la salud y su propio criterio y supervisión seguirán siendo piezas clave en la recomendación.
1La traducción al español del citado documento ha sido editada por el Ministerio de Sanidad, Política Social e Igualdad y puede consultarse on-line en: http://whqlibdoc.who.int/publications/2007/9789241563437_spa.pdf
2http://www.google.es/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&ved=0CC4QFjAA&url=http%3A%2F%2Fwww.ema.europa.eu%2Fdocs%2Fen_GB%2Fdocument_library%2FOther%2F2013%2F08%2FWC500147372.pdf&ei=n055UrycJObt0gWz4IDwDQ&usg=AFQjCNENJ3pOwPFDN1rliPT3z4mOrTrITw&bvm=bv.55980276,d.bGE&cad=rja
3Directiva 2004/24/CE, de 31 de marzo de 2004, por la que se modifica, en lo que se refiere a los medicamentos tradicionales a base de plantas, la Directiva 2001/83/CE por la que se establece un código comunitario sobre medicamentos para uso humano

