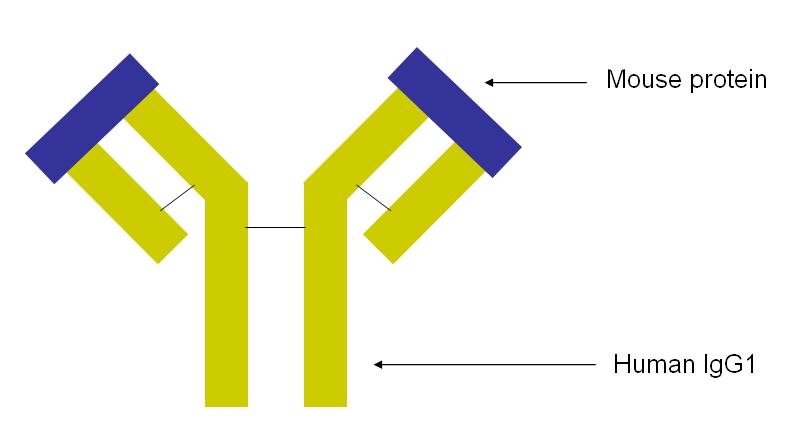
 Es un anticuerpo monoclonal, anticuerpo homogéneo producido por un clon de células, y quimérico, el 75% es humano y el 25% es procedente de un ratón.
Es un anticuerpo monoclonal, anticuerpo homogéneo producido por un clon de células, y quimérico, el 75% es humano y el 25% es procedente de un ratón.
Este anticuerpo es de la clase Ig1. Las regiones constantes de inmunoglobulinas son humanas y las regiones variables del ratón.
Mecanismo de acción
El infliximab neutraliza la actividad biológica del TNFα, mensajero químico y una parte clave en la reacción autoinmune, al unirse con gran afinidad a las formas solubles y transmembranas de esta citocina e impidiendo la unión de éstas a sus receptores.
Efectos farmacodinámicos
En artritis reumatoide después del tratamiento con infliximab se redujo el número de células inflamatorias en las áreas inflamadas de la articulación y también se redujo la expresión de las moléculas que medían la adhesión celular, quimioatracción y degradación tisular. Disminuyeron los niveles de interleuquina 6 sérica y proteína C reactiva, y se aumentaron los niveles de hemoglobina, en comparación con el valor basal.
El tratamiento con infliximab produce en pacientes con psoriasis una normalización de la diferenciación de los queratinocitos en las placas psoriásicas y una disminución de la inflamación epidérmica. En pacientes con artritis psoriásica, el tratamiento con infliximab redujo la vascularización en tejido sinovial, el número de células T y las lesiones psoriásicas de la piel.
Las biopsias de colon, obtenidas antes y después de la administración con infliximab, muestran que se ha reducido el TNFα.
Posología
El infliximab se administra por vía intravenosa, normalmente a intervalos de 6-8 semanas, y en servicio hospitalario. No se puede administrar vía oral debido a que el sistema digestivo destruiría este medicamento.
La infusión debe realizarse con supervisión médica, con un periodo de observación de dos horas, debido a la posibilidad de reacciones agudas relacionadas con la perfusión. Por este motivo debe mantenerse preparado durante la infusión un carro de emergencia que contenga adrenalina, antihistamínicos, corticoides y ventilación artificial. Para prevenir el riesgo de reacción relacionado a la perfusión, puede administrarse previamente un antihistamínico y un corticoide y en caso de ser necesario disminuir la velocidad de goteo.
Nuevos usos
Se están investigando los beneficios de la administración de infliximab en diferentes patologías, como por ejemplo la enfermedad de Kawasaki.
La enfermedad de Kawasaki es una vasculitis multisistémica de etiología desconocida que puede tratarse de un trastorno autoinmunitario. Afecta a las membranas mucosas, los ganglios linfáticos, las paredes de los vasos sanguíneos y el corazón. Puede causar inflamación de los vasos sanguíneos en las arterias, especialmente las arterias coronarias, lo cual puede llevar a que se presenten aneurismas. En Estados Unidos esta enfermedad es la principal causa de cardiopatía en niños y la mayoría de los pacientes son menores de 5 años.
Realizaron un estudio a pacientes con esta patología; concretamente, a pacientes con enfermedad de Kawasaki con persistencia de la fiebre después de haberles administrado una gammaglobulina intravenosa se les administró infliximab. Los 20 pacientes tratados con este fármaco tuvieron menos días de fiebre y de estancia hospitalaria, sin efectos adversos.
Bibliografía
1. European Medicines Agency. Remicade, infliximab. Ficha técnica o resumen de las características del producto. URL: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000240/human_med_001023.jsp&mid=WC0b01ac058001d124
2. Janssen. Parmaceutical companies of Johnson-Johnson. Remicade, Solución inyectable.
URL: http://www.medicamentosplm.com/productos/remicade_solucion_inyectable.htm#3430
3. Elena Corinaldesi, Adriana H. Tremoulet y cols. Infliximab for Intravenous Immunoglobulin Resistance in Kawasaki Disease: A Retrospective Study. Journal of Pediatrics April 2011; 158 (4): 644-649.e.1
4. Isolda Budnik O, Tamara Hirsch B, Carlos Fernández C, Leticia Yanez P, Juanita Zamorano R. Kawasaki disease: a clinical serie. Revista chilena de infectología 2011; 28(5): 416-422.
