Introducción
Cuando hablamos del diagnóstico en las demencias, en primer lugar es importante conocer la definición de demencia y cuáles son los criterios que debe cumplir un paciente para establecer este diagnóstico.
Definición
La demencia se define como un síndrome clínico caracterizado por un deterioro cognitivo que provoca un declinar de las funciones intelectuales adquiridas previamente (es necesario la afectación de dos o más funciones), con preservación del nivel de vigilancia y que además interfiere de manera significativa en la realización de las actividades de la vida diaria. Por tanto, la presencia de la alteración de estas funciones intelectuales marcará el diagnóstico del síndrome de demencia, más allá de la detección del deterioro cognitivo.
Criterios diagnósticos de demencia
Tanto la Asociación Americana de Psiquiatría (DSM-IV-TR) como la Organización Mundial de la Salud (CIE-10) han expuesto unos criterios diagnósticos propios. Los primeros están más orientados hacia la clínica, y los de la CIE-10 se centran en la investigación (tablas 1 y 2).
 |  |
Estos criterios tienen algunos inconvenientes, ya que dan una mayor importancia a la afectación de la memoria sobre otras áreas cognitivas (como el lenguaje, las praxias o las gnosias), cosa que es importante en la enfermedad de Alzheimer (EA), pero no tanto en otros trastornos cognitivos, como la demencia frontotemporal. Tampoco tienen en cuenta los síntomas conductuales, que son fundamentales en el diagnóstico de otros tipos de demencia, como la de cuerpos de Lewy.
Sin embargo, el principal problema que presentan estos criterios es la exigencia de que las actividades de la vida diaria se hayan visto alteradas, lo que retrasa el diagnóstico en numerosas ocasiones. Por ello, para conseguir un diagnóstico precoz de estos trastornos algunos investigadores establecieron el concepto de deterioro cognitivo leve (DCL) (Petersen et al., 1999), que consiste en una alteración de la memoria superior a la esperada para la edad del paciente, pero manteniendo una buena función cognitiva global y sin que se vean afectadas las actividades de la vida diaria. En este concepto estarían englobados sujetos que nunca evolucionarían a demencia y otros que sí, en los que se habría hecho el diagnóstico en una fase sintomática muy incipiente.
Hoy se entiende que dentro de la enfermedad de Alzheimer hay un espectro del deterioro cognitivo que podría ser el siguiente:
Envejecimiento normal → EA asintomática → quejas cognitivas subjetivas → deterioro cognitivo leve → demencia.
Entre las demencias, la EA es sin duda la más frecuente (con un porcentaje superior al 50%), aunque existen otros tipos de demencias que tendrán unas características clínicas distintas, además de un sustrato anatomopatológico bien diferenciado.
El proceso diagnóstico ante un paciente con sospecha de demencia
Ante un paciente con sospecha de deterioro cognitivo, y una vez descartado un síndrome confusional agudo, realizaremos una anamnesis dirigida para obtener información relevante que pueda ayudarnos en el diagnóstico (antecedentes familiares de demencia, nivel educativo, capacidad funcional y habilidades sociales previas, presencia de traumatismos craneales o neoplasias, factores de riesgo vascular, fármacos que pueden afectar al nivel cognitivo, etc.).
Además, la historia clínica y la anamnesis realizada con el paciente deberá complementarse con la información que pueda aportarnos un «informador fiable» (ya sea la pareja u otro familiar), que sin duda nos ofrecerá datos de primera mano de la situación real del paciente, ya que éste muchas veces no es consciente de su enfermedad y tiende a negar los problemas cognitivos que presenta.
Por otro lado, la anamnesis debe completarse con una exploración general y neurológica, y de forma imprescindible con una evaluación cognitiva, que realizaremos mediante una exploración neuropsicológica. También valoraremos los datos referentes a la esfera anímica y los síntomas conductuales, que nos ayudarán a diferenciar el tipo de demencia.
Asimismo, estableceremos la capacidad funcional del paciente, requisito imprescindible ya que forma parte de los criterios de demencia. Estas capacidades funcionales hacen referencia a las actividades de la vida diaria, y se clasifican en «básicas» (las necesarias para el autocuidado: movilidad, comer, aseo, vestirse, etc.), «instrumentales» (hacer la compra, manejar dinero, cocinar, uso de electrodomésticos...) y «actividades avanzadas» (trabajo, deportes, aficiones, viajes, actividades sociales, etc.).
En último lugar, podemos realizar pruebas complementarias de neuroimagen (tomografía axial computarizada [TAC] o resonancia cerebral), además de estudios analíticos bioquímicos y serológicos, más o menos completos, que nos ayuden a diferenciar las demencias secundarias de las degenerativas primarias, y de esta manera detectar aquellas que son potencialmente tratables.
Importancia del diagnóstico precoz
El problema de los actuales criterios diagnósticos estriba en que no son válidos para establecer el diagnóstico en fases iniciales de la demencia, y aún menos en las fases preclínicas.
Desde que disponemos de un tratamiento sintomático para la EA, se ha hecho de nuevo evidente la necesidad de poder realizar un diagnóstico precoz que nos permita iniciar cuanto antes este tipo de tratamientos, para poder mantener al paciente durante más tiempo en una situación menos evolucionada de la enfermedad, e incluso retrasar su posible institucionalización. Además, el diagnóstico precoz conlleva una serie de ventajas, como poder planificar las estrategias en la evolución de la enfermedad y aumentar la seguridad (evitando, por ejemplo, accidentes en la conducción, problemas en la cocina, con las finanzas, etc.) o realizar una educación temprana de los cuidadores.
Por otro lado, hay una implicación más importante si cabe, que es la relacionada con la investigación y evaluación de tratamientos que sean capaces de cambiar el curso de la enfermedad.
Es necesario precisar el concepto de «diagnóstico precoz» de la EA, ya que el verdadero diagnóstico precoz sería aquel que nos permitiese detectar la presencia de los procesos patológicos, antes incluso del inicio de los síntomas (fase preclínica). Y ello a pesar de que el diagnóstico precoz real es aquel diagnóstico clínico que se realiza cuando ya han comenzado los síntomas, aunque no se cumplan todavía los criterios del síndrome de demencia.
En la actualidad existen diversos marcadores diagnósticos (biomarcadores y otras pruebas diagnósticas) que son capaces de detectar algunos cambios patológicos presentes antes del inicio de la clínica. Los más importantes son los siguientes:
• Biomarcadores del líquido cefalorraquídeo (LCR). El LCR está en contacto directo con el sistema nervioso central, y es sin duda la fuente más importante de biomarcadores. Éstos están relacionados con la histopatología clásica y el depósito del péptido del betaamiloide (A1-42) en las placas amiloideas extracelulares, así como con el depósito de proteína tau en los ovillos neurofibrilares intracelulares. Al compararlos con sujetos de la misma edad con niveles cognitivos normales, se ha observado que el LCR de los pacientes con EA muestra niveles bajos de A1-42 y niveles altos de proteína tau total y tau fosforilada. Ninguno de estos biomarcadores por separado tiene la suficiente sensibilidad y especificidad como para ser usado en el diagnóstico de la EA. Además, no debemos olvidar que el LCR se obtiene mediante una punción lumbar, que a pesar de ser una técnica segura no deja de ser invasiva.
• Biomarcadores en plasma. También se han buscado marcadores en el plasma (por su mayor facilidad de obtención), pero actualmente ninguno de los estudiados han dado los resultados esperados.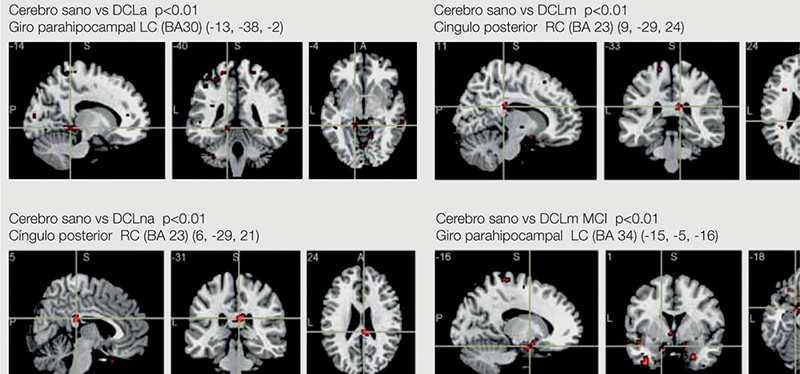 • Neuroimagen estructural y funcional:
• Neuroimagen estructural y funcional:
– La resonancia magnética (RM) cerebral es la técnica de imagen más usada en diagnóstico e investigación, ya que es capaz de mostrar una reducción del volumen cerebral en zonas concretas (sobre todo en el hipocampo) y ha demostrado ser un marcador bastante fiable de EA y de la conversión de deterioro cognitivo leve a EA. Además de la volumetría, se han usado otras técnicas con menos sensibilidad y especificidad hasta la fecha (figura 1).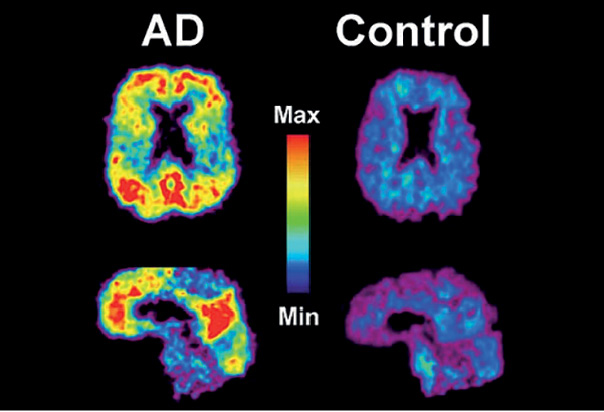 – Otra técnica importante es la tomografía por emisión de positrones (PET, positron emission tomography), con la que, mediante un radioisótopo (18FDG-PET), puede detectarse la disminución del metabolismo cerebral que ya está presente en fases tempranas de la EA en áreas temporales y parietales, cíngulo posterior, hipocampo y otras áreas cerebrales. Además, podemos realizar una PET con el compuesto Pittsburgh (C-PiB), que es un marcador de la presencia de betaamiloide in vivo porque se fija en los depósitos de este a nivel cerebral, y de manera consistente se ha observado una mayor captación de este compuesto a nivel de la corteza cerebral parieto-temporal y frontal en pacientes con EA comparados con sujetos sanos, lo que indica de manera indirecta una mayor presencia de betaamiloide en los cerebros de pacientes con EA (figura 2).
– Otra técnica importante es la tomografía por emisión de positrones (PET, positron emission tomography), con la que, mediante un radioisótopo (18FDG-PET), puede detectarse la disminución del metabolismo cerebral que ya está presente en fases tempranas de la EA en áreas temporales y parietales, cíngulo posterior, hipocampo y otras áreas cerebrales. Además, podemos realizar una PET con el compuesto Pittsburgh (C-PiB), que es un marcador de la presencia de betaamiloide in vivo porque se fija en los depósitos de este a nivel cerebral, y de manera consistente se ha observado una mayor captación de este compuesto a nivel de la corteza cerebral parieto-temporal y frontal en pacientes con EA comparados con sujetos sanos, lo que indica de manera indirecta una mayor presencia de betaamiloide en los cerebros de pacientes con EA (figura 2).
• Evaluación cognitiva. Técnicas de estudio neuropsicológico. Estas técnicas contribuyen en gran medida al diagnóstico precoz de la EA. De hecho, la evaluación neuropsicológica puede demostrar la presencia de déficits cognitivos de 1 a 3 años antes de la aparición del síndrome. Los déficits cognitivos que podemos detectar y que se han descrito como posibles predictores de la EA son la alteración de la memoria episódica, la capacidad de razonamiento abstracto, la fluencia verbal y la capacidad nominativa. Los test neuropsicológicos parten con una ventaja respecto a los otros marcadores diagnósticos: tienen un bajo coste, son bien tolerados por el paciente y carecen de efectos adversos.
• Pruebas genéticas. La detección de las mutaciones de unos genes localizados en los cromosomas 1, 14 y 21 nos permite obtener un diagnóstico de certeza de enfermedad de Alzheimer in vivo. No obstante, estas mutaciones sólo están presentes en menos del 1% de todos los casos de EA, concretamente en las formas familiares con herencia autosómica dominante. Por otro lado, la presencia del alelo E4 de la apolipoproteína E es el factor de riesgo genético mejor establecido para el desarrollo de la EA. Sin embargo, su presencia no predice la aparición de EA con la exactitud deseada, y su ausencia no descarta otras demencias, por lo que hoy en día no se emplea de forma sistemática en el estudio de las demencias.
Cuando analizamos todas estas técnicas de diagnóstico precoz, observamos que ninguna de ellas por separado tiene la suficiente sensibilidad y especificidad como para darnos el diagnóstico (si exceptuamos las mutaciones genéticas de las formas de EA familiar). No obstante, la combinación de estudios de neuroimagen con el análisis de biomarcadores en el LCR puede aumentar la sensibilidad y especificidad, aunque su poder predictivo todavía no se ha confirmado. Debido a que son técnicas costosas (la PET, por ejemplo) y a que son invasivas (biomarcadores en el LCR), la mayoría sólo se emplean en el ámbito de ensayos clínicos o, como en el caso de las pruebas genéticas, en pacientes con alta sospecha de EA familiar. Sólo la RM cerebral y sobre todo los estudios neuropsicológicos tienen un valor en la práctica clínica habitual en el diagnóstico precoz, y son ampliamente usados por los clínicos. Por todo ello, la evaluación cognitiva de las exploraciones neuropsicológicas merece un desarrollo más amplio en el siguiente apartado.
Evaluación cognitiva en las exploraciones neuropsicológicas
La evaluación cognitiva es el elemento esencial y diferenciador de la evaluación clínica del paciente con sospecha de demencia. Los trastornos neuropsicológicos forman la clínica principal en las demencias desde el inicio hasta las fases más avanzadas, y por lo tanto la exploración neuropsicológica es pieza clave en su diagnóstico.
La neuropsicología diagnóstica es la rama de la psicología que pretende determinar, a través de la realización de unos test o baterías de preguntas que tengan un mayor grado de predicción, si los pacientes examinados cumplen los criterios diagnósticos de demencia. Se trata de averiguar qué capacidades cognitivas están alteradas y cuáles preservadas, para poder definir así un perfil clínico.
Los resultados obtenidos pueden procesarse de dos formas:
• Con criterios comparativos que valoran los resultados obtenidos por el paciente contrastándolos con los de su grupo sociodemográfico.
• Con criterios diagnósticos en los que se han establecido unos puntos de corte a partir de estudios epidemiológicos previos, que buscan establecer la mejor sensibilidad y especificidad.
La aplicación de los estudios neuropsicológicos está enfocada principalmente al inicio de los síntomas, en la fase del deterioro cognitivo leve, para poder determinar qué pacientes evolucionarán a una EA y cuáles no. Además, permiten establecer un evolución del deterioro cognitivo mediante la aplicación de forma seriada de los mismos cada 6 o 12 meses. No suelen emplearse en los estadios avanzados de la enfermedad, momento en que resulta difícil o casi imposible realizar una valoración neuropsicológica.
La valoración cognitiva puede realizarla un médico de atención primaria o un especialista en neurología; sin embargo, si es preciso realizar una valoración más exhaustiva con una exploración neuropsicológica, deberá llevarla a cabo un neuropsicólogo.
Además existe el concepto de «neuropsicología modular», que establece que una buena exploración neuropsicológica debe realizarse en fases que representan distintas aproximaciones al reconocimiento y cuantificación de los trastornos del paciente. En los siguientes apartados, se analizan las distintas fases de la neuropsicología modular.
Fase I. Exploración básica: los test de cribado y la entrevista estructurada
Si partimos de una buena historia clínica, primero realizamos una entrevista estructurada con unos test breves de cribado. Estos cuestionarios constan de preguntas o pruebas sencillas que evalúan distintos ámbitos cognitivos, como la orientación, la memoria, el lenguaje, la lectura o las praxias. Suelen ser test rápidos de realizar, y la puntuación que obtenemos nos proporciona el índice del estado cognitivo, que a partir de un punto de corte nos da una posible patología. Un buen test de cribado debe ser:
• Rápido de realizar (debe durar 10 minutos o menos).
• Fácil, puesto que los emplean médicos o profesionales sanitarios que no son expertos en demencias.
• Simple (cuanta menos instrumentación mejor).
• Aplicable a todo tipo de personas, incluidas las analfabetas.
• Adaptable a todos los idiomas y entornos culturales.
• Además, deben evaluar distintos dominios cognitivos (como lenguaje, memoria, praxias, etc.) y, por supuesto, su uso no puede estar restringido.
Los test de cribado nos ayudan a seleccionar a aquellos pacientes a los que es preciso realizar una exploración neuropsicológica más detallada, pero nunca nos darán un diagnóstico definitivo.
Existen muchos test de este tipo; a continuación se detallan los más importantes: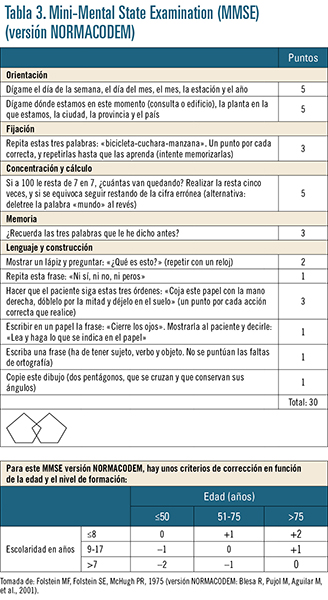 • Mini-Mental State Examination (MMSE) (tabla 3). Es el instrumento más usado a escala internacional. Puntúa sobre un máximo de 30 puntos, de los que la mayor parte de ellos corresponden a la orientación temporoespacial (10) y al lenguaje (8), y sólo 3 a la memoria. Se considera anómala una puntuación de 23 o inferior. Existe una versión inicial anglosajona (Folstein et al., 1975), de la que se realizó una versión española (Lobo et al., 1979), que puntuaba sobre 35 porque se añadieron dos ítems, aunque posteriormente los mismos autores validaron una versión española sobre 30 puntos (Lobo et al., 1999) para poder equiparar los resultados con los obtenidos por otros autores a escala internacional. El MMSE tiene una serie de limitaciones e inconvenientes:
• Mini-Mental State Examination (MMSE) (tabla 3). Es el instrumento más usado a escala internacional. Puntúa sobre un máximo de 30 puntos, de los que la mayor parte de ellos corresponden a la orientación temporoespacial (10) y al lenguaje (8), y sólo 3 a la memoria. Se considera anómala una puntuación de 23 o inferior. Existe una versión inicial anglosajona (Folstein et al., 1975), de la que se realizó una versión española (Lobo et al., 1979), que puntuaba sobre 35 porque se añadieron dos ítems, aunque posteriormente los mismos autores validaron una versión española sobre 30 puntos (Lobo et al., 1999) para poder equiparar los resultados con los obtenidos por otros autores a escala internacional. El MMSE tiene una serie de limitaciones e inconvenientes:
– Presenta el llamado «fenómeno techo o suelo» en función del nivel cultural del paciente (los sujetos con un nivel intelectual previo alto puntúan normal a pesar de presentar alteraciones cognitivas evidentes, y los pacientes con bajo nivel cultural pueden puntuar bajo a pesar de no tener alteraciones cognitivas).
– Tiene un nivel de validez y fiabilidad moderado, con una especificidad limitada por el alto índice de falsos positivos en el caso de personas con bajo nivel cultural, o en aquellos que presentan déficits sensoriales como hipoacusia o son de edad avanzada.
– Existen múltiples versiones, y su aplicación no está estandarizada.
El punto de corte se establece en 24, por lo que los resultados por debajo se considerarán anormales. Tanto esta versión de 30 puntos como la de 35 han demostrado tener un buen rendimiento diagnóstico.
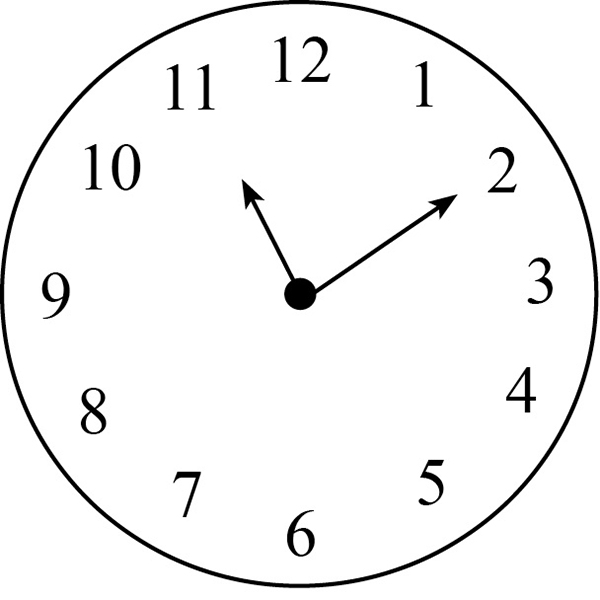
• Test del reloj. Consiste en pedirle al paciente que dibuje un reloj cuyas manecillas marquen una hora determinada (once y diez en países de habla hispana). Se puede realizar a la orden y a la copia, y puntúa sobre 10 puntos, en los que el punto de corte se establece en los 6 puntos: por encima de esta cifra el resultado es normal, y por debajo patológico, siendo el 6 limítrofe. Es un test rápido y no se ve tan influido por el nivel cultural del sujeto, aunque no evalúa la memoria inmediata (figura 3 y tabla 4).
 | 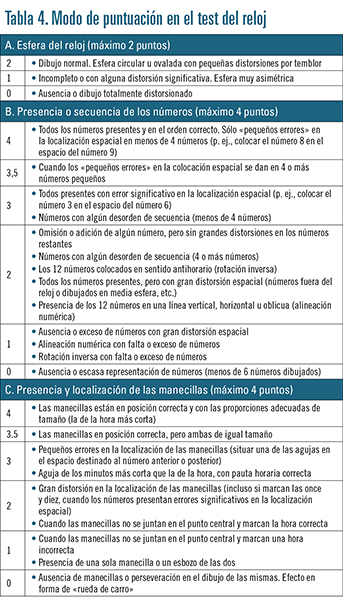 |
 • Test de Pfeiffer. Consta de 10 ítems que evalúan orientación, información y memoria, y un cálculo simple (tabla 5).
• Test de Pfeiffer. Consta de 10 ítems que evalúan orientación, información y memoria, y un cálculo simple (tabla 5).
• Otros test de cribado rápido:
– Memory Impairment Screen (MIS). Cuestionario breve de recuerdo libre y facilitado de 4 palabras que el sujeto debe leer. Sólo evalúa memoria, y no es adecuado para analfabetos.
– Eurotest. Consiste en una prueba breve y fácil que emplea monedas de curso legal (euros), y que no se ve afectada por el nivel cultural del paciente; además, es extrapolable a los países que empleen el mismo tipo de moneda.
– Test de los 7 minutos. Combina pruebas de orientación, memoria facilitada y fluidez (enumerar nombres de animales en un minuto), junto con el test del reloj. La evidencia clínica es que, por norma general, aplicarlo cuesta mucho más de 7 minutos.
Respecto a los test de cribado rápido, debemos tener en cuenta las siguientes recomendaciones:
– Lo ideal es complementar las pruebas cognitivas realizadas al paciente con cuestionarios cumplimentados por el informador/familiar elegido (al seleccionarlo, debemos asegurarnos de que se trata de un informador fiable).
– Todos los test son válidos, pero se recomienda usar siempre los mismos para poder tener más experiencia a la hora de aplicarlos.
– Debemos elegir aquellos test que requieran menos tareas de «papel y lápiz» o que se vean poco influidos por el nivel cultural del paciente.
– Cuando evaluemos los resultados, debemos evitar clasificarlos entre alterados y normales, introduciendo también la opción de «dudoso», en cuyo caso aplicaremos un segundo test.
Fase II. Exploración neuropsicológica avanzada
Tras realizar la entrevista estructurada y los test de cribado, se puede recurrir a una batería fija de preguntas que realice una valoración general de las capacidades mentales superiores. Esta fase constituye la entrada a la exploración neuropsicológica formal. Las baterías de preguntas más usadas son las siguientes:
• Alzheimer's Disease Assesment Scale (ADAS). Hay una parte que evalúa la cognición, y otra no cognitiva (depresión, alucinaciones, apetito, ideas delirantes, etc.).
• Cambridge Index of Mental Disorder in the Elderly (CAMDEX).
• Consortium to Establish a Registry for Alzheimer's Disease (CERAD). Entre sus apartados, contiene uno para la evaluación neuropsicológica.
Si es preciso profundizar aún más en la exploración neuropsicológica, podemos seleccionar aquellos test, baterías o subaterías estandarizados, en función de los objetivos marcados. No obstante, estas valoraciones son más complejas que los test de cribado, por lo que generalmente deben ser aplicadas por personal experto y entrenado para ello (las realizan habitualmente neuropsicólogos).
En definitiva, podemos concluir que, ante la falta de unos marcadores biológicos diagnósticos lo suficientemente fiables, las exploraciones neuropsicológicas (tanto los test de cribado como los cuestionarios más complejos) son las pruebas que más contribuyen en la práctica clínica habitual a realizar un diagnóstico precoz de las demencias.
Bibliografía
Alberca Serrano R, López-Pousa S, eds. Enfermedad de Alzheimer y otras demencias, 4.ª ed. Madrid: Médica Panamericana, 2011.
Blesa R, Pujol M, Aguilar M, et al. Clinical validity of the "mini-mental state" for Spanish speaking communities. Neurosychol. 2001; 39 (11): 1.150-1.157.
Folstein MF, Folstein SE, McHugh PR. Mini Mental State. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 1975; 12: 189-198.
Lobo A, Ezquerra J, Gómez Burgada F, et al. El miniexamen cognoscitivo (un «test» sencillo y práctico para detectar alteraciones intelectuales en pacientes médicos). Actas Luso Esp Neurol Psiquiatric Cienc. 1979; 7(3): 189-202.
Martín Carrasco M, Bulbena Vilarrasa A. Diagnóstico precoz de la enfermedad de Alzheimer. Psiq Biol. 2003; 10(4): 119-132.
Valls-Pedret C, Molinuevo JL, Rami L. Diagnóstico precoz de la enfermedad de Alzheimer: fase prodrómica y preclínica. Rev Neurol. 2010;51: 471-480.
Weiner MF, Lipton AM, eds. Manual de enfermedad de Alzheimer y otras demencias. Madrid: Médica Panamericana, 2010.


