Introducción
En el organismo hay una producción continua de especies reactivas del oxígeno (ROS); en unos casos, como consecuencia de procesos fisiológicos (respiración celular, meta-bolismo enzimático...) y en otros, de la exposición a factores exógenos (radiación UV, tabaco, amianto...). Cuando el equilibro entre la producción de ROS y los mecanismos antioxidantes fisiológicos se descompensa, los radicales libres pueden llegar a interac-cionar con el material genético generando diversas lesiones en el ADN(1)
La guanina es la base nitrogenada con menor potencial de oxidación y, por tanto, más fácil de oxidar por el principal radical libre implicado en el daño oxidativo, el radical hidroxilo (HO•) (figura 1). Su producto de oxidación mayoritario, 8-OH-2'-dG, se ha convertido en uno de los marcadores de estrés oxidativo más estudiado en los últimos años. Además, 8-OH-2'-dG es una molécula promutagénica capaz de aparearse con adenosina en vez de citosina durante la replicación (transversiones GC TA). Por todo ello, un aumento de la concentración de 8-OH-2'-dG en muestras biológicas (suero, orina, saliva, tejidos...) se puede relacionar con numerosas patologías (cáncer, enfer-medades neurodegenerativas, diabetes...), así como con el envejecimiento o con la exposición a agentes exógenos dañinos.
Uno de los métodos más usados en la determinación de 8-OH-2'-dG es la cromatografía líquida de alta eficacia con detección amperométrica (HPLC-EC). En este trabajo, se propone la detección indirecta de lesiones en el ADN mediante la monitorización simultánea de 8-OH-2'-dG y 2'-dG, metabolito fisiológico del que procede. De este modo, se puede conocer en un solo análisis la relación 8-OH-2'dG/2'dG a la hora de cuantificar el daño oxidativo producido por la exposición a un agente tóxico.
Material y métodos
Reactivos
Los reactivos 8-OH-2'-dG y 2'-dG fueron suministrados por Sigma-Aldrich. Se disolvie-ron en fase móvil y, en el caso de la 2'-dG, se añadieron unas gotas de NaOH para favorecer su disolución. Las disoluciones patrón se almacenaron en la nevera durante el tiempo que duraron los ensayos y se filtraron antes de proceder a su análisis.
Método Instrumental: HPLC-EC
Como método de separación analítica, se optó por la cromatografía líquida de alta eficacia en fase inversa. Se utilizó un cromatógrafo HPLC (BAS CC-5) equipado con un sistema de bombeo Gilson 307 y un sistema de inyección Rheodyne 7125. El volumen de inyección fue de 20 µL. Como fase estacionaria, se utilizó una columna analítica (Atlantis C18) con un diámetro interno de 3.0 µm y unas dimensiones de 4.6 mm x 100 mm. Como fase móvil, una disolución tampón de pH 5.5 compuesta por: KH2PO4 (0.68045% m/v), metanol (7% v/v), KOH para ajustar el pH y agua ultrapura como disolvente. El caudal fue de 0.8 mL/min.
Se seleccionó un sistema de detección electroquímico, con un detector BAS LC-4B equipado con un electrodo de trabajo de carbón vítreo, un electrodo de referencia de Ag/AgCl y un electrodo auxiliar de acero inoxidable. La detección simultánea de 8-OH-2'-dG y 2'-dG se llevó a cabo a un potencial de trabajo de 1100 mV. El software utilizado fue Power Chrom 280.
Detección de 8-OH-2'-dG y 2'-dG
En primer lugar, y con el objetivo de establecer el potencial de trabajo adecuado para la detección simultánea de ambos compuestos, se estudió el efecto del potencial apli-cado sobre el electrodo de trabajo en la señal obtenida (figura 2). A continuación, para comprobar la relación entre la respuesta electroquímica obtenida y la concentración de los analitos, se realizaron las curvas de calibrado que aparecen en la figura 3. Por último, se obtuvo el cromatograma que se muestra en la figura 4.
Resultados
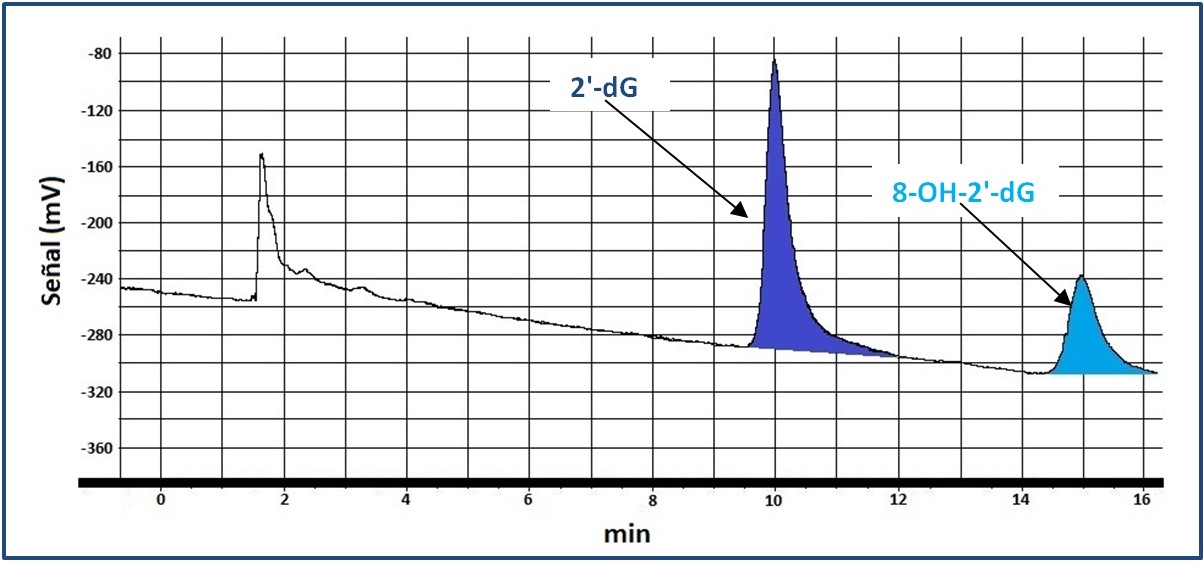 |
A partir del cromatograma, se calcularon los siguientes parámetros cromatográficos: resolución de la columna (Rs = 5.02), factor de selectividad (α = 1.60), factor de capaci-dad (K'2'-dG = 5.11; K'8-OH-2'-dG = 8.17), factor de asimetría (Af2'-dG (10%h) = 1.05; Af8-OH-2'-dG (10%h) = 1.55) y factor de cola (Tf2'-dG (10%h) = 1.03; Tf8-OH-2'-dG (10%h) = 1.27).
Discusión
Potencial de trabajo
HPLC-EC es un método ampliamente utilizado para la detección de 8-OH-2'-dG. Según la bibliografía consultada (2) (3), el potencial de trabajo al que se suelen hacer dichos experimentos, está comprendido entre 700 mV y 800 mV. Como se muestra en la Figu-ra 2B, aunque la 8-OH-2'-dG presenta una respuesta estable a partir de aproximadamente 750 mV, la respuesta de la 2'dG empieza a aparecer a partir de 900 mV y aumenta hasta 1100 mV, potencial al que se estabiliza. A pesar de los incon-venientes que presenta el uso de potenciales tan elevados y viendo el perfil de la curva mostrada en la Figura 2A, se seleccionó un potencial de 1100 mV como potencial de trabajo para conseguir mayor sensibilidad y precisión en la medida de 2'-dG.
Curvas de calibrado
En la Figura 3, se representan las curvas de calibrado para 2'-dG y 8-OH-2'-dG respectivamente. En ambos casos, para cada medida se realizaron tres replicados a un potencial de 1100 mV. Se obtuvieron buenos coeficientes de correlación (0.9994 y 0.9997 respectivamente) e intervalos lineales para concentraciones comprendidas entre 1•10-6 M y 5•10-8 M.
Cromatograma
La Figura 4 muestra el cromatograma obtenido al inyectar 20 µL de una disolución 1•10-6 M de 2'-dG y 8-OH-2'-dG. La elevada resolución obtenida permite llevar a cabo el análisis cualitativo y cuantitativo simultáneo de los compuestos de interés.
En cuanto al orden de elución de los analitos, al contrario de lo esperado, el compues-to más apolar eluye en primer lugar, probablemente debido a la estructura tridimensional que adquieren los analitos al solubilizarse en la fase móvil.
Conclusión
Dada la importancia de la 8-OH-2'dG como marcador biológico de estrés oxidativo y la utilidad de la relación 8-OH-2'dG/2'dG en estudios de cuantificación de la exposición a agentes tóxicos, el método cromatográfico propuesto puede ser muy útil para la de-tección simultánea de 2'-dG y 8-OH-2'dG. Se obtiene un intervalo lineal entre 1•10-6 M y 5•10-8 M y los compuestos se separan con adecuada resolución y eficacia.
Bibliografía
1. Valavanidis A, Vlachogianni T, Fiotakis C. 8-hydroxy-2'-deoxyguanosine (8-OHdG): A Critical Biomarker of Oxidative Stress and Carcinogenesis. J Environ Sci Health C. 2009; Part C, 27:120–139.
2. Duez M, Helson M, Some TI, Dubois J, Hanocq M. Chromatographic Determination of 8-oxo-7,8.dihydro-2'-deoxyguanosine in Cellular DNA: A Validation Study. Free Rad Res. 2000; 33: 243 - 260.
3. Schmerold I, Niedermüller H. Levels of 8-hydroxy-2'-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague-Dawley rats. Exp Gerontol. 2001; 36: 1375 - 1386.
4. Koide S, Kinoshita Y, Ito N, Kimura J, Yokoyama K, Karube I. Determination of human serum 8-hydroxy-2'-deoxyguanosine (8-OHdG) by HPLC -ECD combined with solid phase extraction (SPE). Journal of Chromatography B. 2010; 878: 2163 - 2167.
5. Cadet J, Delatour T, Douki T, Gasparutto D, Pouget JP, Ravanat JL, et al. Hydroxyl radicals and DNA base damage. Mutat Res. 1998; 424: 9 - 21.
