Fundamento y motivación del servicio
El objetivo de la profesión farmacéutica es conseguir los mejores resultados en salud para los pacientes mediante el uso adecuado del medicamento. Para ello, el servicio de farmacia realiza actividades que comprenden todo el circuito del medicamento: desde su selección y su posicionamiento hasta la dispensación y seguimiento clínico de los pacientes. Con el fin de maximizar la efectividad de los tratamientos, el farmacéutico busca mejorar la adherencia de los pacientes.
Hay ciertos fármacos que se dispensan en farmacia ambulatoria que tienen una especial problemática en cuanto a su posología y, por tanto, puede comprometer su correcta adherencia. El grupo de fármacos que suelen tener pautas más complejas son sobre todo los citostáticos orales, que en los últimos años han ido ganando importancia en oncología. Por ello, surge la necesidad de implantar un servicio farmacéutico que ayude a facilitar a los pacientes el seguimiento correcto de las pautas de estos tratamientos con tal complejidad posológica. En este trabajo nos hemos querido centrar en un fármaco en concreto, la temozolomida, ya que su pauta es bastante compleja, la adherencia de la cual se pretende mejorar mediante la implantación de un sistema personalizado de dosificación (SPD).
Para diseñar este nuevo servicio farmacéutico, debemos plantearnos una serie de preguntas1. En primer lugar, nos preguntaremos cuál es el panorama actual de control de adherencia en la terapia de temozolomida para el glioblastoma; a continuación, nos preguntamos a dónde queremos llegar y, por último, cómo podemos llegar a ese objetivo.
¿En qué situación nos encontramos?
La Organización Mundial de la Salud define la adherencia como la «extensión en la que el comportamiento de una persona, tomando medicación, siguiendo una dieta y/o realizando cambios en el estilo de vida, se corresponde con las recomendaciones del profesional de la salud»2.
La adherencia en tratamientos antineoplásicos se ha estudiado en otros cánceres distintos al glioblastoma, principalmente en el cáncer de mama con terapia hormonal adyuvante, y en pacientes con leucemia mieloide crónica3. Las principales causas del incumplimiento terapéutico en estos estudios fueron: incidencia en alguna dosis de efectos adversos y olvido de las instrucciones de administración.
Existe una clara influencia de la incidencia y gravedad de los efectos adversos, que en el caso de los citostáticos son de especial relevancia, con la frecuencia de dosis y adherencia de éstos, siendo su relación inversamente proporcional entre frecuencia de dosis y adherencia3. La adherencia es un fenómeno complejo influenciado por distintos factores:
- Factores relacionados con el paciente. Incluyen principalmente la edad y las comorbilidades. Los pacientes con glioblastoma se someten a un tipo de cirugía que puede dejar secuelas cognitivas relevantes, como pérdida de la memoria inmediata, lo que puede dificultar la correcta adherencia y el adecuado cumplimiento del tratamiento.
- Relacionados con los profesionales de la salud: falta de formación sobre efectos adversos e inecuación del seguimiento
- Relacionados con la educación: falta de entendimiento de la importancia del tratamiento y de las consecuencias patológicas por la falta de adherencia.
- Factores socioeconómicos y familiares: ausencia de apoyo familiar y conflicto de responsabilidades.
- Relacionados con el tratamiento: efectos adversos, interacciones, complejidad del régimen, polifarmacia, duración prolongada del tratamiento y alta frecuencia de dosis. La complejidad del régimen y los efectos adversos son los dos parámetros complejos del tratamiento con temozolomida. El servicio farmacéutico planteado pretende solventar los problemas que conlleva la complejidad de este tratamiento. En la práctica, en las entrevistas en el servicio de farmacia ambulatoria, se ha observado que son muchos los pacientes que no gestionan correctamente las dosis con múltiples cápsulas, pudiéndose encontrar infra/supradosificados en algunas ocasiones.
Los efectos adversos cada vez son menores con la terapia dirigida antineoplásica, pero la temozolomida conlleva un conjunto de efectos adversos que pueden llegar a ser graves.
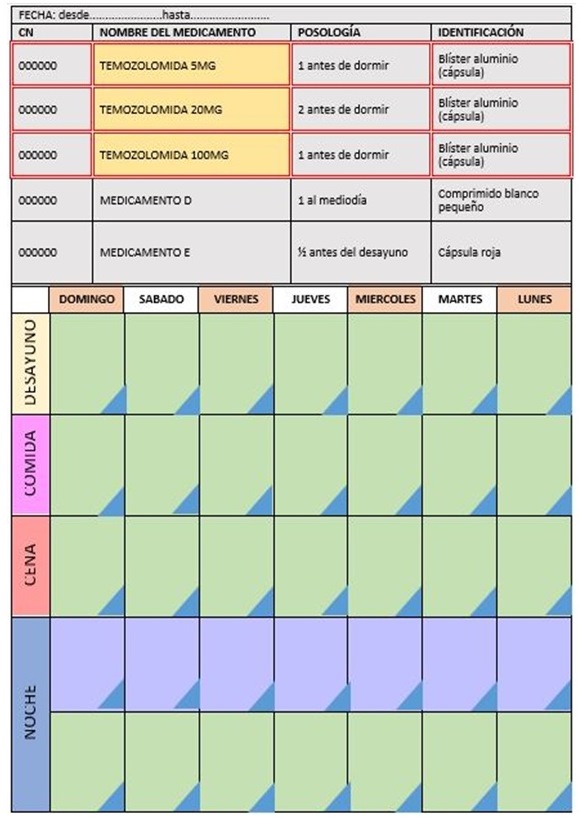
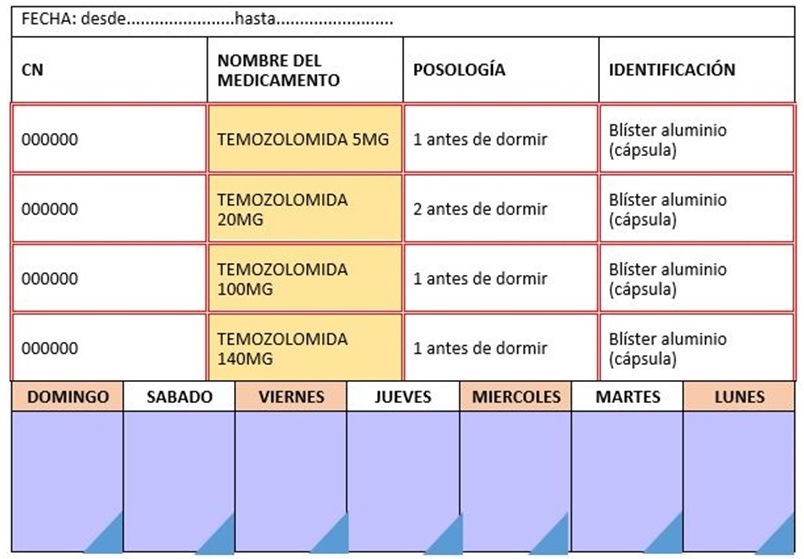
No obstante, en el caso de la temozolomida, un factor muy influyente en su adherencia es la posología ajustada a parámetros antropométricos. Ésta se calcula por la superficie corporal del paciente, por lo que depende del peso y la altura, además del grado de toxicidad hematológica que produce y de la evolución del tumor. Por ello, la dosis total varía mucho entre los diferentes pacientes. Así, para llegar a la dosis completa hay que hacer una combinación de cápsulas de temozolomida con las dosis comercializadas (5, 20, 140, 180, 250 mg). Esto conlleva que el paciente casi siempre se tenga que tomar a la vez varias cápsulas de distintas cajas de dosificaciones diferentes.
¿Dónde queremos llegar?
Buscamos optimizar la terapia de temozolomida en el paciente con glioblastoma y proporcionarle la información completa sobre su tratamiento con el fin de mejorar su seguridad y comprensión, potenciar su autonomía, favorecer una correcta adherencia al tratamiento y mejorar los resultados terapéuticos.
Este proyecto podría ayudar a cumplir con uno de los objetivos del «Plan Estratégico de Atención Farmacéutica al Paciente Oncohematológico: Líneas Estratégicas y Objetivos 2020»4, llevado a cabo por, el Grupo de Desarrollo de la Farmacia Oncológica (GEDEFO) de la Sociedad Española de Farmacia Hospitalaria (SEFH). En uno de sus apartados incluye cambios organizativos y tecnológicos que permitan mejorar la organización y calidad de la atención oncohematológica. Contempla la inclusión de servicios de farmacia hospitalaria de elementos dirigidos a asegurar una adherencia adecuada y la correcta educación sanitaria del paciente sobre su medicación.
Este proyecto tiene como objetivo introducir cambios organizativos, tecnológicos y en procesos, que permitan mejorar la organización y la calidad, así como la seguridad y el cuidado integral en el proceso farmacoterapéutico del paciente oncohematológico (OH). Dentro de este apartado, en el punto 1.9 figura: «Los servicios de farmacia dispondrán de un sistema de información y atención farmacéutica ambulatoria de la farmacoterapéutica del paciente OH con elementos de ayuda en atención farmacéutica, trazabilidad y seguridad». Entre ellos se incluyen los elementos dirigidos a asegurar la adherencia y la correcta educación sanitaria del paciente sobre su medicación. Dentro de estos elementos tecnológicos para asegurar la adherencia podríamos incluir el SPD, además de la educación del paciente en las entrevistas iniciales y de seguimiento que se llevarían a cabo.
El farmacéutico debe ocupar un lugar estratégico como promotor de la adherencia, en su integración en el equipo multidisciplinario de atención al paciente con cáncer y la relación directa con el paciente a través de la dispensación de tratamientos orales.
¿Cómo podemos llegar a este objetivo?
A. Implantación del SPD en el tratamiento con temozolomida, junto con las correspondientes entrevistas con el farmacéutico en las cuales se le haría al paciente una serie de preguntas para el estudio de la adherencia:
Las recomendaciones de Multinacional Asociation of Supportive Care in Cancer (MOATT©)5 plantean preguntas clave para las visitas iniciales. Éstas permiten saber si el paciente conoce el plan terapéutico, el tratamiento actual, su habilidad por obtener la medicación y la toma de ésta. Se podrían utilizar como referencia las preguntas utilizadas en el artículo mencionado anteriormente sobre la adherencia de otros antineoplásicos3.
B. Estudio comparativo para evaluar las diferencias entre los pacientes que utilizan el SPD y los que no se han acogido a este servicio en cuanto a eficacia terapéutica, seguridad, etc. El estudio de la adherencia se llevaría a cabo mediante:
- Recuento de cápsulas del SPD devuelto.
- Entrevistas al paciente realizando, por ejemplo, las preguntas anteriores.
- Test de Morisky-Green.
Además, se identificarán los motivos de falta de adherencia para intentar mejorar el sistema.
C. Analizar los resultados obtenidos, y valorar aplicar el SPD también a otros citostáticos orales con pautas complejas.
Destinatarios del servicio y campaña de comunicación
Este servicio farmacéutico iría destinado a pacientes con glioblastoma que están en tratamiento con temozolomida en el Hospital del Mar u otros hospitales con servicio de farmacia ambulatoria que atiendan a pacientes oncológicos.
La campaña de comunicación sería llevada a cabo por el farmacéutico de farmacia ambulatoria, que sería el encargado de comunicar las instrucciones del SPD y las características y precauciones del fármaco al paciente. Previamente, también el farmacéutico se encargaría de informar al médico especialista prescriptor del citostático para que éste se lo comunique primeramente al paciente cuando él decida que debe tomar temozolomida. También se le daría al médico unos dípticos para entregar al paciente antes de que tenga la primera entrevista con farmacia, para que tenga la información por escrito sobre el servicio farmacéutico que se le ofrecerá.
Descripción del servicio (materiales y métodos) y plan de actuación (personal y tiempo dedicado, precio del servicio, usuarios receptores del servicio)
Presentación del servicio
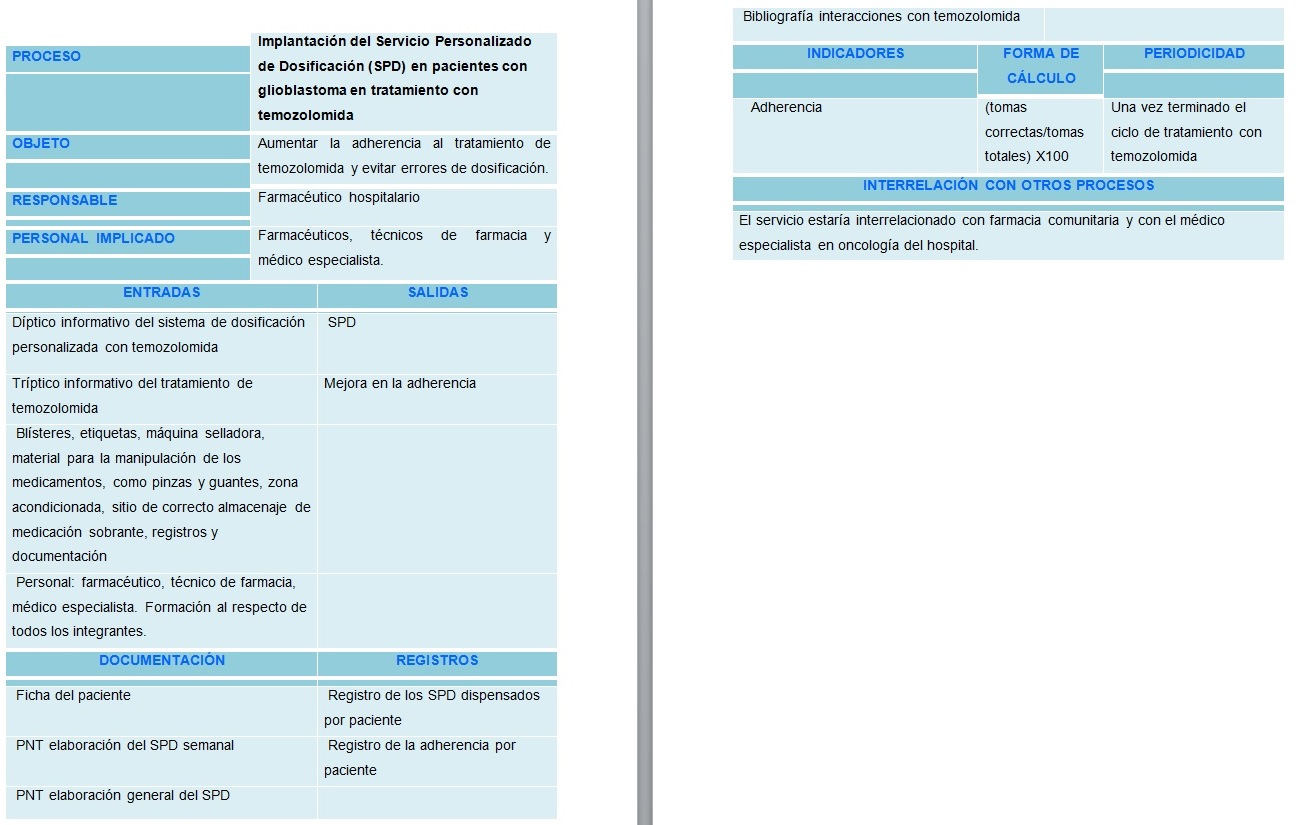
El SPD tiene como objetivo principal evitar los errores de medicación derivados de la complejidad de toma de este citostático y, por tanto, optimizar su adherencia. La dosis es muy variable entre los pacientes, ya que depende de diversos factores: peso, altura, niveles de leucos, evolución del tumor. Por ello, hay muchas presentaciones del mismo fármaco, y muchas veces para llegar a la dosis prescrita se tienen que hacer combinaciones de distintas presentaciones, lo que representa una importante fuente de errores que repercute en la correcta adherencia.
Además de aplicar el SPD para la temozolomida, si el paciente toma más fármacos susceptibles de figurar en un SPD, éstos también se incluirían en un principio en el SPD. Así, se dispondrá de otro modelo de SPD donde haya 2 alvéolos por día y momento de tomarlo: uno para la temozolomida y otro para el resto de medicación. De esta forma, el paciente podrá tener toda la medicación que toma en un mismo dispositivo, lo que mejorará la adherencia de todos sus tratamientos.
Esquema del proceso
Personal y tiempo invertido
El personal involucrado en el servicio son los farmacéuticos de farmacia ambulatoria y al principio también el médico especialista, que tendrá que comunicar previamente al paciente que se le ofrecerá este servicio desde farmacia y entregarle el díptico informativo. Además, tendría que haber un segundo farmacéutico implicado que haría las revisiones de los SPD elaborados.
El tiempo invertido del servicio se podría calcular de forma desglosada:
- Entrevistas con el paciente (aproximadamente 30 min).
- Revisar medicación y comprobar la ausencia de interacciones (aproximadamente 15 min).
- Elaboración del SPD (aproximadamente 20 min).
El farmacéutico deberá comprometerse a cumplir la Ley de Protección de Datos, seguir los procesos y normas de calidad, custodiar la medicación de la farmacia y avisar al paciente con antelación para que traiga la medicación habitual, gestionar las recetas de temozolomida, informar y aclarar cualquier duda que tenga el paciente, detectar errores en el cumplimiento terapéutico y procurar que sean corregidos.
Precio del servicio
Según el Consejo Catalán del Colegio Oficial de Farmacéuticos (COF), para que un SPD en farmacia comunitaria sea rentable, su precio debe ser, al menos, de 19,85 euros por paciente y mes. Para este cálculo se tuvieron en cuenta los costes de preparación, con un tiempo invertido de 12,5 minutos, los de intervención (7,7 min), las entrevistas (60 min) y el material6. Las entrevistas en este caso se realizan igualmente, porque se trata de un fármaco que requiere un especial control, por lo que podría eliminarse de la ecuación.
En el ámbito de farmacia hospitalaria, el coste de este servicio sería de 0 euros para el paciente, ya que sería financiado por Sanidad Pública como optimización de la adherencia al fármaco. Al mismo tiempo, también supondría un ahorro del gasto público, ya que es previsible que se pierdan menos dosis de citostáticos debido a errores en la medicación, ingresos hospitalarios, consultas al médico, etc., por una mala adherencia, siendo muy probablemente mayor el ahorro económico que el coste del servicio.
Método de inclusión del paciente
Una vez el médico haya informado de la posibilidad de adherirse al programa de SPD con temozolomida y de que el paciente haya leído detenidamente el díptico informativo, éste acudirá a la entrevista inicial con el farmacéutico, tal como se muestra en el esquema del proceso.
Mediante la firma de la autorización y el consentimiento informado, el paciente constata que:
- Conoce el funcionamiento del SPD.
- Que traerá la medicación con antelación para poder realizar el SPD con garantías.
- Que cumplirá las condiciones de conservación y seguridad del blíster.
- Que entregará los blísteres vacíos al recoger la nueva medicación.
Una vez se incluya el paciente en el programa, deberá informarse al médico especialista y al de cabecera en el caso de que incluya la medicación habitual en el SPD. Esta comunicación se hará a través del programa informático propio del hospital o con una anotación en el perfil del paciente del centro de atención primaria.
Equipamiento
El servicio de farmacia ambulatoria del hospital que quiera realizar el SPD deberá disponer de:
Zona de atención personalizada
Que permita hacerlo de manera reservada y garantizando su confidencialidad. En este caso, pueden utilizarse para este fin los despachos del servicio de farmacia ambulatoria.
Zona de preparación y reacondicionamiento
Dispondrá de una mesa de trabajo de material liso y sin grietas para permitir su fácil limpieza y desinfección. Nunca tendremos otro material que pueda interferir en la elaboración del SPD o representar una contaminación cruzada. Sobre la mesa sólo encontraremos los medicamentos de un único paciente para evitar errores.
Zona de almacenamiento
Para la temozolomida y la medicación habitual de cada paciente, separados correctamente.
Material básico de elaboración del SPD
Como las cápsulas se encuentran en el blíster, no se tiene que seguir un cuidado especial, ya que se introducirán en el SPD sin quitarlas del blíster, recortadas unitariamente:
• Dispositivos:
– Dispositivos SPD (blísteres) completos o simples, homologados y certificados por el fabricante.
– Máquina selladora.
– Etiquetas.
• Elaboración:
– Material para la manipulación de los medicamentos, como pinzas y guantes.
– Utillaje necesario para fraccionar comprimidos en los SPD completos.
• Almacenamiento: cajones o similares, identificados con el nombre del paciente.
• Información y registros informatizados que garantice la confidencialidad de los datos sobre la salud (LOPD):
– Ficha del paciente.
– Ficha de elaboración del SPD para el paciente.
– Procedimientos normalizados de trabajo (PNT) de elaboración de SPD.
– Autorización y consentimiento informado escaneado.
– Acceso a la receta electrónica actualizada y a la orden médica del médico especializado en oncología.
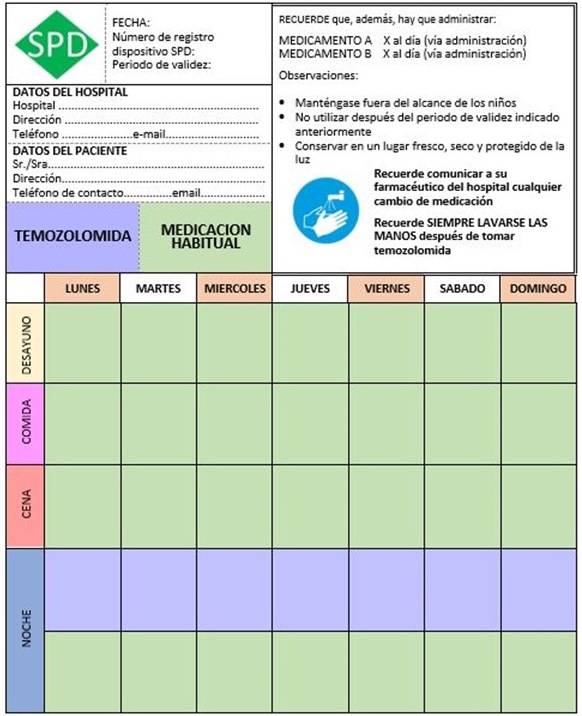
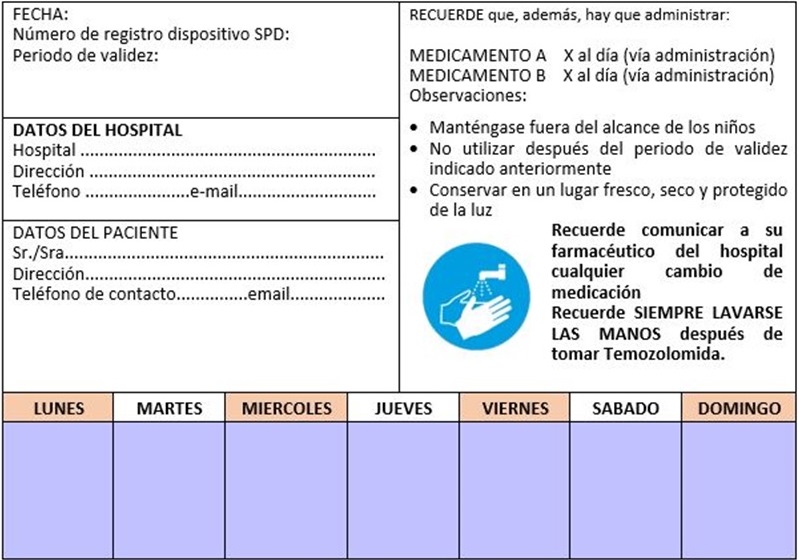
– Tríptico informativo de la temozolomida (figura 1) y díptico informativo del SPD (figura 2).
Bibliografía
Guías de oncohematología respecto a la adherencia y la manipulación.
Diseño del dispositivo SPD
1. Dispositivo SPD completo: blíster que contiene la pauta de temozolomida y la medicación habitual:
• Anverso del blíster:
• Reverso del blíster:
2. Dispositivo SPD simple: sólo contiene la pauta de temozolomida.
• Anverso del blíster:
• Reverso del blíster:
Periodicidad en la dispensación de los distintos SPD
Ficha del proceso
Valoración del servicio (puntos fuertes y débiles)
Todos los servicios tienen puntos fuertes y débiles. A continuación se exponen los de mayor importancia:
El servicio de SPD ya se ofrece en la mayoría de las farmacias comunitarias del Estado, y muchos pacientes se adhieren a estos programas. Éstas tienen una ventaja frente al servicio que nosotras presentamos, y es que el farmacéutico comunitario puede retirar la medicación directamente con la receta electrónica del paciente, y elaborarlo. En el caso del SPD de temozolomida completo, necesitamos que el paciente nos traiga la medicación habitual para la elaboración del SPD, lo que puede generar problemas o confusiones. Si esto ocasionará un problema mayor, podría plantearse la posibilidad de que el farmacéutico del hospital retirara la medicación con autorización del paciente de la receta electrónica actualizada. En este supuesto caso sería de especial relevancia la comunicación entre el médico de cabecera y el farmacéutico responsable de la elaboración del SPD.
Reflexiones que compartir
Decidimos diseñar este servicio farmacéutico tras observar que los pacientes con glioblastoma se equivocaban frecuentemente con la dosis de temozolomida.
La responsabilidad de la adherencia siempre recae en el paciente, ya sea con diarios, aplicaciones móviles para recordar las tomas, etc. Nosotras creemos que como profesionales de la salud deberíamos facilitar la adherencia a tratamientos de tal importancia como son los oncológicos, y con esta complejidad. Los pacientes con glioblastoma en tratamiento con este fármaco han sido intervenidos quirúrgicamente previamente, y las secuelas cognitivas, como la pérdida de memoria inmediata, son frecuentes. Lo que pretendemos con los SPD en este caso es rebajar la responsabilidad del paciente de tener que estar atento a las cápsulas necesarias para completar la dosis. La responsabilidad de la adherencia es conjunta entre pacientes y farmacéuticos, y éstos deben colaborar para evitar errores.
Creemos que el servicio que proponemos sería viable porque supondría un ahorro del gasto público, ya que se malgastaría menos citostáticos debido a errores en la medicación, ingresos hospitalarios, consultas al médico, etc., por una mala adherencia, siendo muy probablemente mayor el ahorro económico que el coste del servicio.
Las nuevas técnicas para controlar la adherencia suelen incluir tecnología, que también podría aplicarse en el SPD para controlar cuándo se abrió el cajetín del blíster y poder establecer un control con mayor fiabilidad. Sin embargo, esto implicaría un gasto mucho más elevado.
Bibliografía
1. World Health Organization. Ginebra: National Cancer Control Programmes (NCCP)©, 2018 [consultado el 15 de marzo de 2018]. Disponible en: http://www.who.int/cancer/nccp/en/
2. Gebbia V, Bellavia M, Ferraù F, Valerio MR. Adherence, compliance and persistence to oral antineoplastic therapy: a review focused on chemotherapeutic and biologic agents. Expert Opin Drug Saf. 2012; 11 Supl 1: 49-59.
3. Olivera-Fernández R, Fernández-Ribeiro F, Piñeiro-Corrales G, Crespo-Diz C. Adherencia a tratamientos antineoplásicos orales. Servicio de farmacia del Complejo Hospitalario Universitario de Pontevedra. Servicio de Farmacia del Complejo Hospitalario Universitario de Vigo. Farm Hosp. 2014; 38(6): 475-481.
4. Cajaraville G, et al. Plan Estratégico de Atención Farmacéutica al Paciente Oncohematológico. Líneas estratégicas y objetivos 2020. Grupo de Farmacia Oncológica de la SEFH (GEDEFO), 2016. Disponible en: http://gruposdetrabajo.sefh.es/gedefo/images/stories/documentos/2016/plan%20estratgico%202020.pdf
5. Multinational Association of Supportive care in cancer (MOATT)© 2017 [consultado el 5 de marzo de 2018]. Disponible en: http://www.mascc.org/mc/page.do?sitePageId=89760
6. Diario Farma. 22 de marzo de 2018.
7. Centro de Información Online de Medicamentos de la AEMPS-CIMA. Madrid: Agencia Española del Medicamento y Productos Sanitarios, 2011 [consultado el 18 de enero de 2018]. Disponible en: https://www.aemps.gob.es/cima/publico/home.html
8. Partridge AH, Avorn J, Wang PS, et al. Adherence to therapy with oral antineoplastic agents. J Natl Cancer Inst. 2002; 94.
9. Osterberg L, Blaschke T. Adherence to medication. N Engl J Med. 2005; 353: 487-497, 652-661.
Anexos