Introducción
La enfermedad, tanto en su forma aguda como crónica está producida por el virus de la hepatitis C, que es un pequeño virus ARN, monocatenario y lineal. Presenta gran variabilidad genética, lo que comporta una respuesta variable al tratamiento según el genotipo del virus infectante.
Aproximadamente, entre el 75% y el 85% de las personas que padecen la infección inicial contraen una enfermedad crónica, y entre el 60% y el 70% de las que padecen la infección crónica sufren una hepatopatía crónica; entre un 5% y un 20% contraen cirrosis; y entre un 1% y un 5% mueren por cirrosis o cáncer del hígado. En un 25% de los enfermos de cáncer del hígado la causa fundamental es la hepatitis C.
La finalidad del tratamiento es prevenir las complicaciones de la hepatitis C. Diversos estudios han demostrado que los pacientes que alcanzan una respuesta virológica sostenida (RVS) presentan un mejor pronóstico que los pacientes no tratados o tratados sin éxito, reduciéndose el riesgo de desarrollar cirrosis, carcinoma hepatocelular e incluso la mortalidad. Por ello, el objetivo principal del tratamiento es lograr una respuesta viral sostenida.
El tratamiento estándar actual, tratamiento combinado en doble terapia con peginterferón alfa (P-IFNα 2a o 2b) y ribavirina (RBV), tiene una duración de 48 semanas y ofrece tasas de curación limitadas (<50% en el genotipo 1).
Boceprevir y telaprevir son dos nuevos antivirales que actúan inhibiendo la proteasa NS3/4A, fundamental para la replicación viral del VHC, y se encuentran indicados, en combinación con ribavirina y peginterferón alfa, para el tratamiento de pacientes adultos con hepatitis C crónica (genotipo 1) con enfermedad hepática compensada, tanto naïve como no respondedores a terapias previas. Esto supone un cambio esperanzador en el tratamiento de la hepatitis crónica por el VHC.
Los resultados de los ensayos clínicos con telaprevir y boceprevir muestran una acción antiviral rápida y potente, que se traduce en tasas de curación (RVS) clínica y estadísticamente muy superiores en comparación con el tratamiento estándar.
Puede permitir que se alcance una tasa de curación del 75% en los enfermos infectados por el genotipo 1 que no hayan recibido tratamiento alguno (enfermos naïve) y de cerca del 50% en los que no hayan presentado respuesta a un tratamiento doble previo.
Boceprevir y telaprevir (tablas 1, 2 y 3)
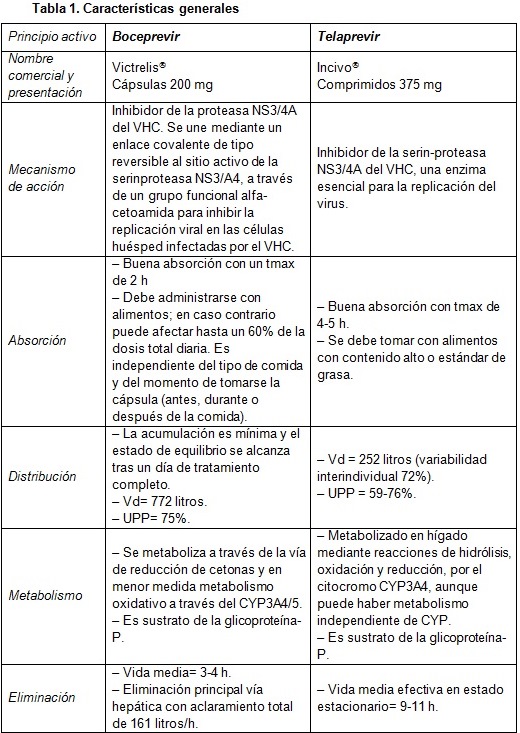 |
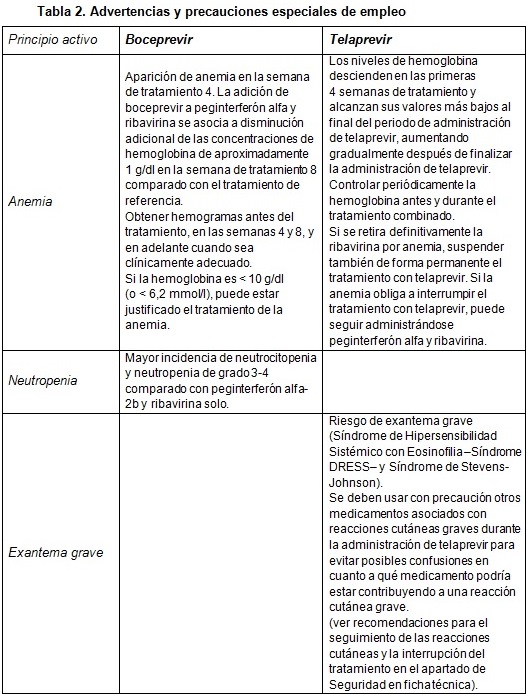 |
Dosis y pautas de administración en pacientes coinfectados por VIH y VHC
El coste por paciente del tratamiento con la biterapia (peginterferón α + ribavirina) es de aproximadamente 6.000 €/año. En cambio, el coste por paciente del tratamiento de la triple terapia (adición de un inhibidor de la proteasa, boceprevir o telaprevir, a la terapia estándar de la hepatitis C) es de unos 32.000 €/año. Es por ello que el Ministerio de Sanidad sacó una serie de recomendaciones donde se describen las situaciones excepcionales en las que se permite la administración de la triterapia. En ellas se incluyen únicamente a pacientes con genotipo 1 y fibrosis hepática F3 o F4; o en casos en los que teniendo fibrosis hepática F0, F1 o F2 además se cumpla: pacientes con alta carga viral y alto nivel de contagio, en función de la situación social/profesional; manifestaciones extrahepáticas de la enfermedad, y mujer joven con deseo de procrear.
El tratamiento con ambos medicamentos debe ser iniciado y supervisado por un medico con experiencia en el manejo de la infección por VIH y de la hepatitis crónica por el VHC.
La dosis de boceprevir es de 800 mg (4 capsulas) cada 8 horas (se recomienda intervalo de 7 a 9 horas), administrados con comida. Los pacientes deben tragar los comprimidos enteros (sin masticar, triturar o disolver).
La duración total del tratamiento es de 48 semanas. Boceprevir debe administrarse en combinación con P-INF alfa (2a o 2b) y RBV, iniciándose después de un periodo de 4 semanas de «lead-in» donde solo se administra el P-IFN alfa (2a o 2b) + RBV. Debe mantenerse durante 44 semanas más hasta completar las 48 semanas totales del tratamiento.
A diferencia de lo que ocurre con telaprevir, la mayoría de los estudios de boceprevir se han realizado en combinación con interferón pegilado alfa 2b.
La dosis de telaprevir es de 750 mg (2 comprimidos) cada 8 horas, administrados con la comida. Los pacientes deben tragar los comprimidos enteros (sin masticar, triturar o disolver). Cuando se utilice en combinación con efavirenz (antirretroviral permitido con telaprevir; fármaco inhibidor de la transcriptasa inversa no análogo a los nucleósidos) la dosis recomendada es de 1.125 mg (3 comprimidos) cada 8 horas; mientras que no es necesario el ajuste de dosis de telaprevir cuando se use con etravirina (similar a Efavirenz) a la dosis de 200 mg cada 12 horas, junto con telaprevir a la dosis habitual: 750 mg/8 h.
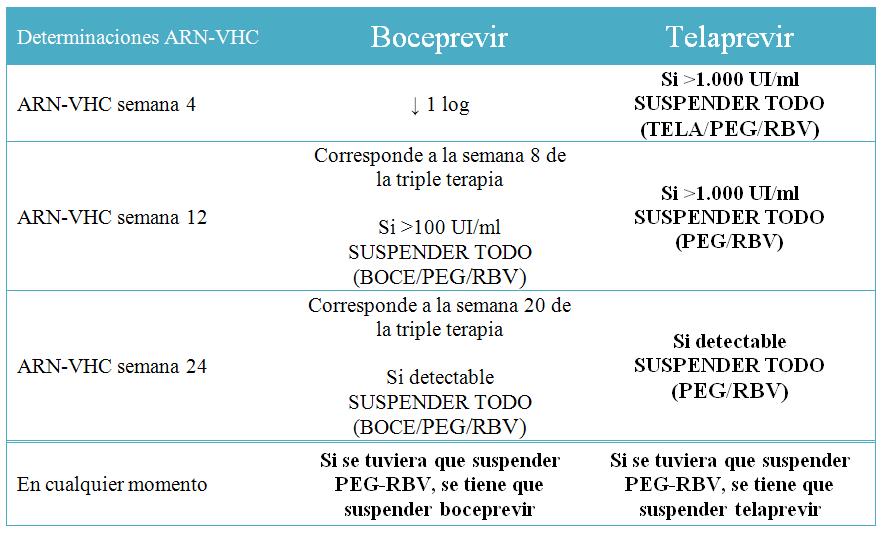 La duración total del tratamiento es de 48 semanas. Telaprevir debe administrarse en combinación con P-INF alfa (2a o 2b) y RBV durante 12 semanas, seguidas de 36 semanas de tratamiento con P-INF alfa (2a o 2b) + RBV hasta completar las 48 semanas totales de tratamiento.
La duración total del tratamiento es de 48 semanas. Telaprevir debe administrarse en combinación con P-INF alfa (2a o 2b) y RBV durante 12 semanas, seguidas de 36 semanas de tratamiento con P-INF alfa (2a o 2b) + RBV hasta completar las 48 semanas totales de tratamiento.
A diferencia de lo que ocurre con boceprevir, la mayor parte del desarrollo clínico de telaprevir se ha realizado utilizando interferón pegilado alfa 2a. En nuestro estudio el mayor porcentaje de pacientes coinfectados con VIH fueron tratados con telaprevir debido a que según ensayos clínicos, existen menos interacciones entre el tratamiento antirretroviral y el Telaprevir, y sus efectos adversos son mejor conocidos.
Objetivos
El objetivo principal del estudio es evaluar la eficacia y seguridad de la triple terapia en el tratamiento de la hepatitis C, y estimar el perfil beneficio/riesgo en la infección crónica de la hepatitis C genotipo 1.
Material y metodología
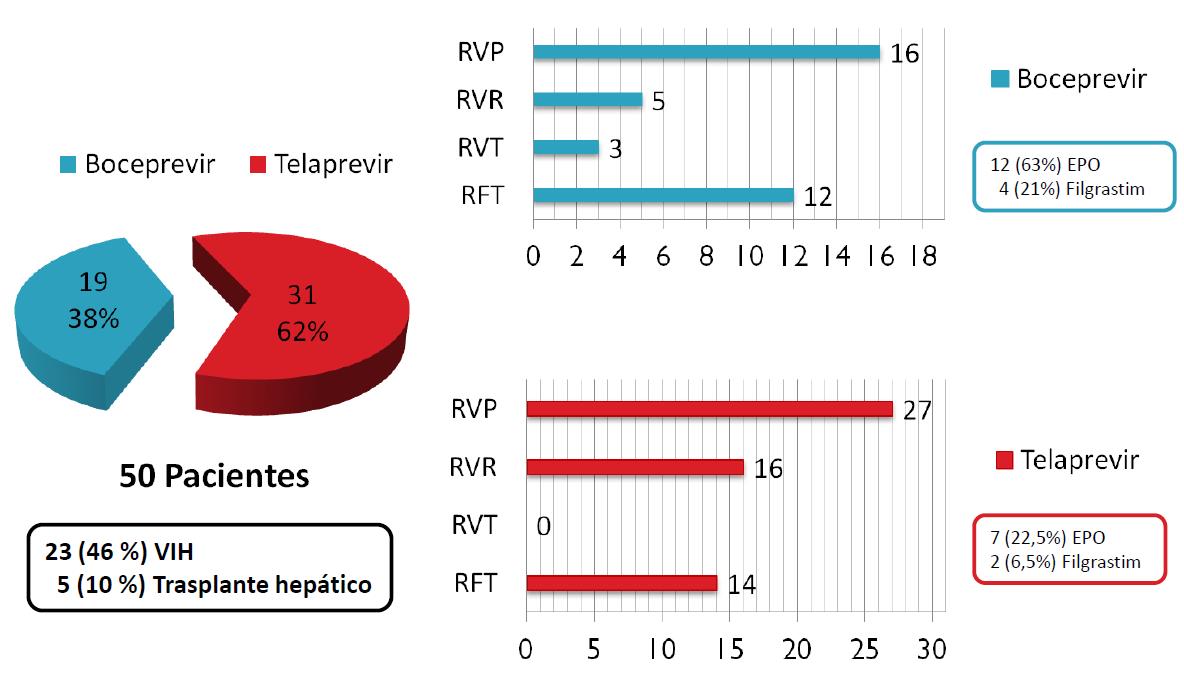
Realizamos el estudio en una población de 50 pacientes con hepatitis C divididos en dos grupos según el tratamiento con el inhibidor de la proteasa usado. Los criterios de inclusión utilizados son: genotipo 1, y fibrosis hepática F3 o F4, y que estuviesen monoinfectados, coinfectados con VIH y/o con trasplante hepático. La duración del estudio es de un año, del cual hay un porcentaje de pacientes que sólo han completado las 24 primeras semanas de tratamiento.
Para la obtención de los datos con los que hemos trabajado se ha dispuesto de los programas que se emplean en el Hospital Ramón y Cajal. Los resultados de viremia se recogieron con el programa de microbiología Microb Dynamic®.
![]() Por otro lado, hemos tenido acceso a las analíticas de todos los pacientes tratados a través del programa de Urgencias de Bioquímica, Nexus IT®, de donde se han obtenido los niveles de hemoglobina y neutrófilos. Junto con esto hemos consultado las fichas técnicas de los medicamentos a través de la página de la Agencia Española de Medicamentos y Productos Sanitarios, y los protocolos del uso compasivo de boceprevir y telaprevir proporcionados por el personal del hospital. (Tabla 4).
Por otro lado, hemos tenido acceso a las analíticas de todos los pacientes tratados a través del programa de Urgencias de Bioquímica, Nexus IT®, de donde se han obtenido los niveles de hemoglobina y neutrófilos. Junto con esto hemos consultado las fichas técnicas de los medicamentos a través de la página de la Agencia Española de Medicamentos y Productos Sanitarios, y los protocolos del uso compasivo de boceprevir y telaprevir proporcionados por el personal del hospital. (Tabla 4).
Metodología
– Respuesta Viral Precoz (RVP): ↓ ≥ 2 logaritmos decimales de la carga viral basal, o negativa en la semana 12.
– Respuesta Viral Rápida (RVR): ↓ de la carga viral por debajo de 50 UI/ml en la semana 4.
– Respuesta Viral Tardía (RVT): positiva pero con disminución de al menos 2 logaritmos decimales en la semana 12 y sea negativa en la semana 24.
– Respuesta Final al Tratamiento (RFT): Carga viral indetectable en la semana 48.
Análisis de resultados
![]() Para analizar los resultados hemos utilizado una tabla de excel (tabla 5) donde hemos incluido todos los pacientes con hepatitis C en tratamiento con la triple terapia, tanto los que han finalizado el tratamiento, como los que están en proceso. En dicha tabla se han introducido los datos de viremia de cada uno de los pacientes en las diferentes fechas que se toman como referencia (inicial, 4 semanas, 12 semanas, 24 semanas, 48 semanas) para conocer si el tratamiento es eficaz.
Para analizar los resultados hemos utilizado una tabla de excel (tabla 5) donde hemos incluido todos los pacientes con hepatitis C en tratamiento con la triple terapia, tanto los que han finalizado el tratamiento, como los que están en proceso. En dicha tabla se han introducido los datos de viremia de cada uno de los pacientes en las diferentes fechas que se toman como referencia (inicial, 4 semanas, 12 semanas, 24 semanas, 48 semanas) para conocer si el tratamiento es eficaz.
Además se han tenido en cuenta los niveles de hemoglobina y neutrófilos en dichas fechas para conocer cómo evolucionaba el paciente en cada una de las etapas y, en caso de estar por debajo de los parámetros de referencia, tratarlos:
– En el caso de anemia: Disminuyendo la dosis de Ribavirina y/o tratamiento con eritropoyetina (Aranesp® o Eprex®).
– En el caso de neutropenia: Disminuyendo la dosis de Peginterferón α, y/o tratamiento con Neupogen®.
Para finalizar, analizamos los datos viendo los pacientes que iban obteniendo las diferentes respuestas que se dan durante el tratamiento (respuesta viral precoz, respuesta viral rápida, respuesta viral tardía, y respuesta final al tratamiento). Esto nos ha ayudado a sacar las conclusiones finales al trabajo realizado (Figuras 3 y 4).
 |
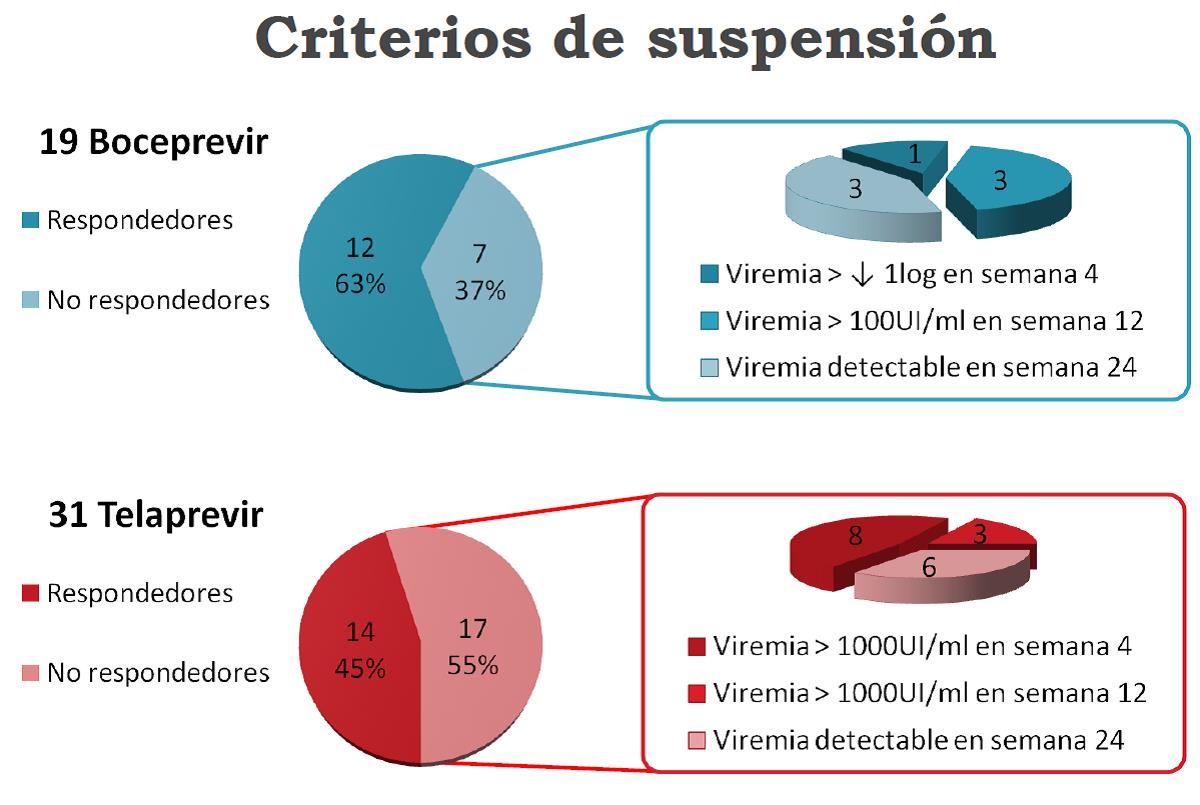 |
Se ha obtenido una eficacia al finalizar el tratamiento con boceprevir del 63%. Los pacientes tratados con telaprevir obtuvieron peores resultados (45%) puesto que la mayoría estaban coinfectados con VIH, y el tratamiento se hace más complejo.
Conclusión
La triple terapia, es decir, la adición de boceprevir o telaprevir a la terapia estándar de la hepatitis C crónica (Peginterferón α + Ribavirina) supone un importante avance terapéutico, pues proporciona una mayor eficacia que el tratamiento clásico, en pacientes con Hepatitis C genotipo 1, tanto naïve como en pacientes pretratados. Por otro lado, la triple terapia ocasiona más efectos secundarios e implica la necesidad de una evaluación más minuciosa y un seguimiento más frecuente de los enfermos en tratamiento.
Bibliografía
Victrelis® (Boceprevir). Ficha Técnica. MSD. Acceso a través de www.ema.europa.eu/. Fecha de acceso: 12/2012.
Incivo® (Telaprevir). Ficha Técnica. Janssen-Cilag. Acceso a través de www.ema.europa.eu/. Fecha de acceso: 12/2012.
Agencia Española de Medicamentos y Productos Sanitarios. Departamento de Medicamentos de Uso Humano. Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C (VHC) en pacientes monoinfectados. INFORME DE UTILIDAD TERAPÉUTICA UT/V1/28022012. Disponible en URL: http://www.aemps.gob.es/. Fecha de acceso: 12/2012.
Protocolo de uso compasivo Boceprevir en pacientes coinfectados por VHC y VIH. Fecha de consulta: 12/2012.
Protocolo de uso compasivo Telaprevir en pacientes coinfectado por VHC y VIH. Fecha de consulta: 12/2012.
Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C en pacientes infectados por el VIH, en trasplante de hígado y en población pediátrica. Fecha de publicación: 26 de Julio de 2012, referencia: RU/V2/20072012.2.
Bibliografía de la imagen: http://whydetox.net/wp-content/uploads/2010/11/liver.jpg
