Personalmente hice un intento con un amigo que no tenía relación alguna con el sector salud, y que creía que la fijación del precio y la financiación de los nuevos medicamentos en nuestro país se hacían de manera informal, un tipo de negociación a la vieja usanza en la que se discute el cuánto y cómo pagar en reuniones con afines y no afines. Lo llamaba el método GOSAT (Groups Of Friends Sitting Around the Table). Traté de explicarle que para nada es así, que desde fases muy tempranas hay un proceso en el que hay que demostrar que el medicamento es seguro, eficaz y eficiente. El proceso de negociación lo lleva a cabo el Ministerio de Sanidad y, al final, quien fija el precio es una comisión (Comisión Interministerial de Precio de Medicamentos [CIPM]) representada por cuatro ministerios y por las comunidades autónomas. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) da apoyo a la toma de decisiones elaborando un informe que sirve para posicionar el medicamento en cuestión respecto a otras alternativas en función de su valor clínico, condicionando así la negociación de precio, si bien no interviene en la negociación directamente. Al final, todo este proceso pretende contribuir a la sostenibilidad del Sistema Nacional de Salud (SNS).
Por la cara que puso, creo que fracasé estrepitosamente. Pero lo cierto es que es bastante complicado explicar el proceso y los diferentes equilibrios de fuerzas que permiten que los nuevos medicamentos con valor añadido sean accesibles a los pacientes.
El arduo camino hasta la fijación de precio y la financiación
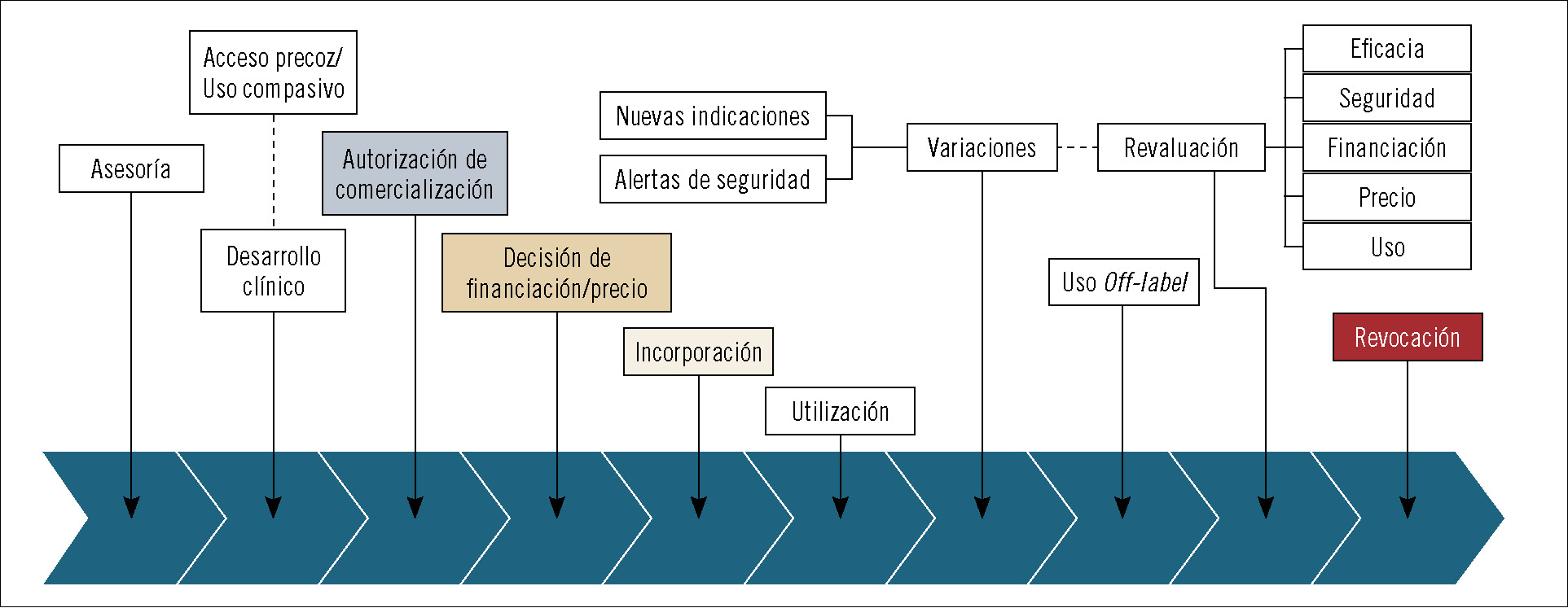
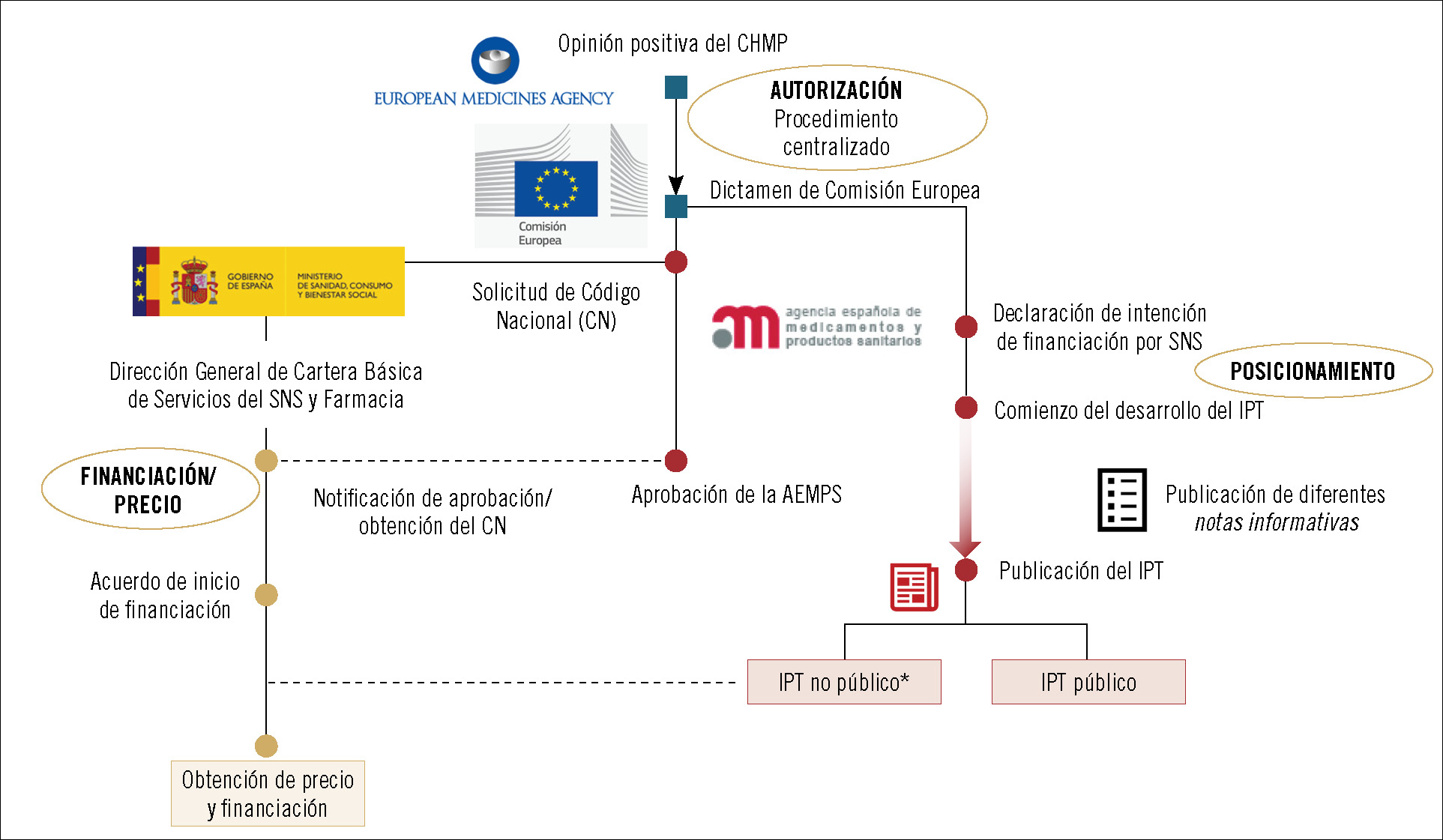
Como sabrán, el camino para que los fármacos logren acceder al mercado es largo y está lleno de barreras necesarias para que el ciudadano pueda hacer uso de ellos con garantías. A la larga fase de desarrollo clínico le siguen una serie de hitos, algunos administrativos, que van desde la autorización del fármaco por las entidades nacionales o supranacionales hasta su posicionamiento dentro del arsenal terapéutico para esa indicación, la decisión de precio y financiación, su utilización a través de los distintos sistemas regionales de salud y la revaluación. Durante todo este periplo, los medicamentos pueden ampliar las indicaciones por las que se autorizó su utilización, lo que obliga a integrar la nueva evidencia de seguridad y eficacia que avale esta ampliación en el conjunto del proceso (figura 1). Según el cauce seguido en la fase de autorización, a lo largo de la vida del fármaco intervienen diferentes organismos e instituciones europeas, nacionales y regionales. Para comprender mejor la fase de posicionamiento del fármaco, interesa mostrar cuándo se activa dicha fase y ver su interrelación con las otras partes del proceso (figura 2).
 |
 |
Autorización de comercialización
Cuando una compañía opta por obtener la autorización de comercialización del fármaco mediante el procedimiento centralizado, entran en acción organismos supranacionales, ya que el solicitante está optando por una autorización para todos los países del Espacio Económico Europeo (Estados miembros de la UE e Islandia, Liechtenstein y Noruega). La solicitud es evaluada por el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA). En caso de que la opinión de este organismo sea positiva, viene el turno de la Comisión Europea, que es la que realmente aprueba la autorización de comercialización mediante un dictamen. Si la compañía opta por el procedimiento nacional, el organismo encargado de evaluar la evidencia (calidad, seguridad y eficacia) para lograr la autorización de comercialización es la AEMPS1. Una vez obtenida por cualquiera de los procedimientos, las compañías deben solicitar un código nacional para cada presentación farmacéutica autorizada, para lo cual se revisa el material de acondicionamiento del fármaco.
Posicionamiento
El posicionamiento comienza al comunicarse la intención de comercialización por parte del solicitante (compañía farmacéutica). La AEMPS, a través del Grupo de Coordinación de Posicionamiento Terapéutico y en colaboración con las comunidades autónomas (mediante la Comisión Permanente de Farmacia del SNS), articula esta fase a través del denominado «informe de posicionamiento terapéutico», que afectará sustancialmente al proceso de financiación y precio.
Financiación y precio
En caso de que se solicite financiación por parte del SNS, una vez se dispone del código nacional la AEMPS lo notifica a la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia (DGCSF), perteneciente al Ministerio de Sanidad, Consumo y Bienestar Social2. La negociación comienza con la entrega por parte de la compañía de documentación clínica (dosier de valor) y farmacoeconómica (análisis del impacto presupuestario, análisis de coste efectividad). A esta fase llegará también un IPT que incluirá información económica (informe no público), y que influirá en la negociación. Tras la decisión de precio y financiación, el IPT se hace público, pudiéndose incluir consideraciones sobre eficiencia.
Informes de posicionamiento terapéutico
Con la introducción de los IPT en 2012/2013, las autoridades sanitarias buscaban ofrecer información que permitiera ubicar un determinado fármaco dentro del arsenal terapéutico existente para una determinada patología o indicación terapéutica, considerando la evidencia científica disponible, es decir, en función de su valor en la clínica. En su elaboración intervienen diferentes agentes clave. En un primer nivel, se encuentran la AEMPS, la DGCSF y las direcciones de Farmacia de las comunidades autónomas. En un segundo nivel, los técnicos y profesionales sanitarios designados por el primer nivel. El tercero lo comprenden las asociaciones de profesionales, las compañías y los pacientes. El plazo estipulado para llevarlo a cabo es de 3 meses3, aunque, como veremos más adelante, este plazo se ha dilatado bastante en la práctica.
El informe parte de un primer borrador elaborado por evaluadores y expertos externos colaboradores de la AEMPS. Las distintas comunidades autónomas aportan consideraciones y consensúan un informe final, que es remitido a las sociedades científicas, asociaciones de pacientes y compañía titular del medicamento, para que realicen a su vez sus consideraciones, aunque no es obligatorio que éstas sean integradas. La información relevante de la fase de decisión de precio y financiación es añadida al IPT como «consideraciones finales»3, en caso de que finalmente se publique4. De acuerdo con el procedimiento publicado, el informe debe contener información sobre la indicación terapéutica (prevalencia, incidencia, pronóstico...) y de eficacia y seguridad3.
Los IPT no son vinculantes, aunque la Ley 10/2013 para el posicionamiento de un fármaco mencione el carácter vinculante del posicionamiento. Trata de ser un informe de referencia, de posición, y sí que extiende su vinculación al consenso alcanzado entre los organismos y agentes clave que han participado en la elaboración4. Esto viene a decir que, si una determinada comunidad autónoma o sociedad científica que haya participado en la elaboración del IPT, va a realizar otra evaluación del medicamento para la misma indicación, el posicionamiento no debería ser sustancialmente distinto al suscrito con anterioridad. Pero más allá de eso, el IPT no tiene carácter coercitivo.
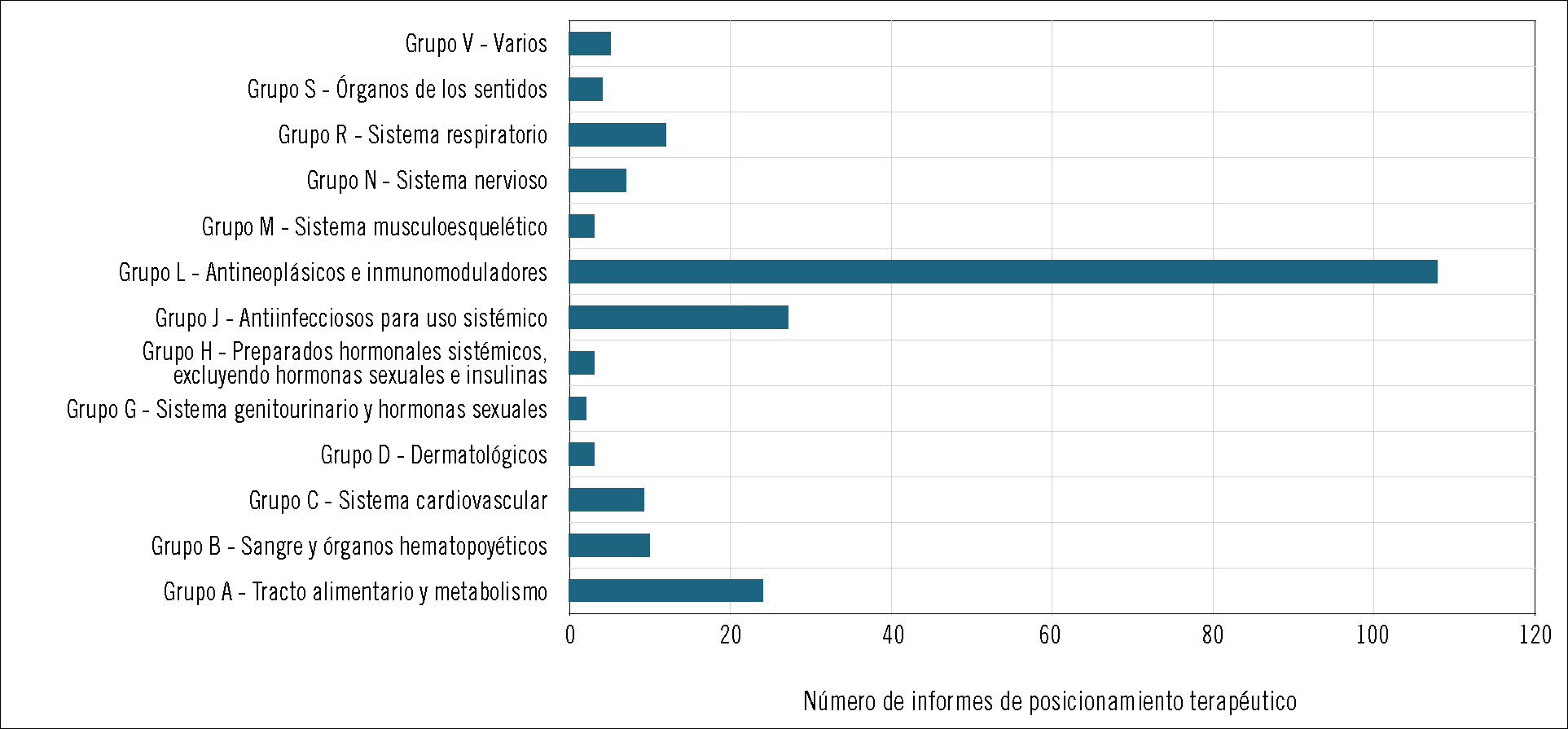
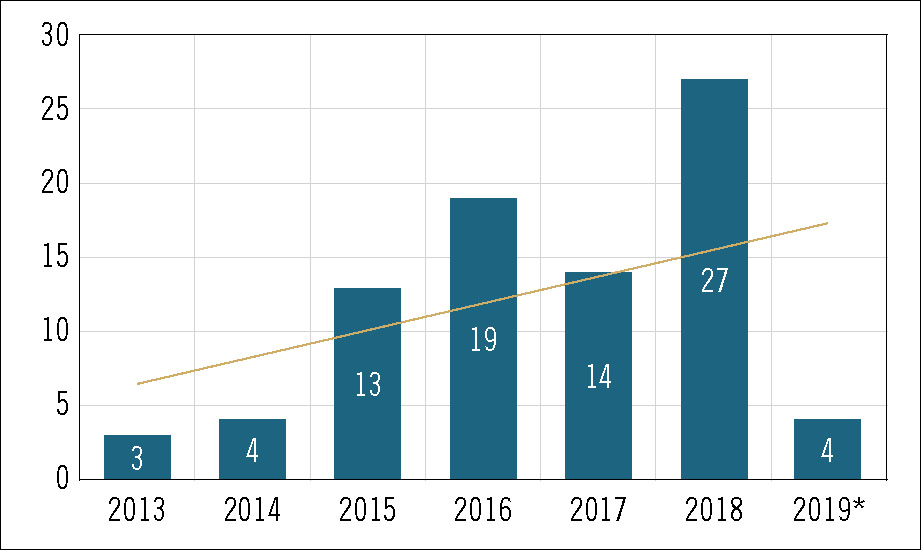
Hasta la fecha se han realizado 217 IPT que abarcan casi la totalidad de los grupos terapéuticos. La mayoría de las evaluaciones (108; 49,8%) se han realizado para fármacos pertenecientes al grupo L de antineoplásicos e inmunomoduladores. De éstos, 78 corresponden a antineoplásicos (subgrupo L01), casi todos entre 2015 y 2018 (sólo en 2018 se publicaron 27 IPT de oncología), coincidiendo con el acceso a fármacos inmunooncológicos en distintas indicaciones (p. ej., cáncer de pulmón no microcítico, mieloma múltiple, carcinoma urotelial, melanoma, etc.). Cabe señalar la cifra de IPT relacionados con el grupo del tracto alimentario y metabolismo (grupo A), con 24 publicaciones, de las cuales 15 corresponden al subgrupo A10 de diabetes, en especial en tratamientos para la diabetes tipo 2. Otro grupo destacable en número de publicaciones de IPT es el de antiinfecciosos para uso sistémico (grupo J), con 19 de sus 27 publicaciones relacionadas con antivirales de uso sistémico (subgrupo J05), en gran parte debido a los nuevos fármacos en hepatitis C y VIH (figuras 3 y 4).
 |
 |
Retos de los IPT
Aunque los IPT se han erigido como una herramienta de referencia para posicionar los nuevos medicamentos y condicionan su fijación de precio y financiación en el SNS en los últimos años, no están exentos de críticas fundadas que señalan en qué aspectos deben incorporar ciertas mejoras.
Incumplimiento de plazos IPT
Parece que el cumplimiento del plazo de 3 meses está resultando difícil de cumplir. Ya en los comienzos de sus publicaciones se apuntó esta situación5, corroborada posteriormente en un análisis de los IPT publicados hasta 2017, que mostró un plazo de 7,21 meses desde el inicio del informe hasta su envío a la DGCSF, y de 14,5 hasta su publicación en la página web de la AEMPS6. No ha sido posible encontrar información de si esta tendencia ha cambiado desde entonces, así que puede que estos plazos se hayan visto reducidos.
Actualización del IPT
La información económica ha ido incorporándose en forma de consideraciones finales en los IPT (p. ej., «la selección tendrá en cuenta criterios de eficiencia»), pero sigue sin haber un apartado específico con evidencia farmacoeconómica en la actualidad7. La buena noticia es que se está trabajando en una propuesta de modificación de los IPT por parte de las autoridades sanitarias en la que se incluirán criterios farmacoeconómicos.
También está el reto de poder incorporar toda la evidencia que se pueda generar en contexto clínico real (real world evidence). Dados los avances de integración de datos y de los sistemas de información de los servicios regionales de salud, ésta va a ser una información de gran valor en el posicionamiento de fármacos, en especial al analizar determinados subgrupos de población.
Consideración como herramienta para limitar el acceso
Si bien los IPT no son a priori una barrera reguladora, sí son vistos como una barrera más para limitar el acceso4. Un ejemplo es su aplicación para la elección de los subgrupos terapéuticos que más se van a beneficiar del medicamento desde el punto de vista clínico y bajo consideraciones de eficiencia. Otra posible causa radica en el hecho de que no sean vinculantes, lo que da pie a sucesivas evaluaciones a escala regional y hospitalaria que pueden aplicar criterios más restrictivos8. Por todo ello, uno de los retos que debería abordarse radicaría en la integración y coordinación de evaluaciones entre organismos de diferentes niveles: nacionales, regionales y hospitalarios.
Conclusión
Dudo mucho ahora de si lograría convencer al amigo con el que debatí en su momento. Quizá siga subyaciendo la idea de que los medicamentos llegan a los hospitales y farmacias comunitarias a través de simples reuniones informales. Pero nada más lejos de la realidad. Es un proceso altamente complejo y exhaustivo en el que, además de procurar evidencia científica que avale que los medicamentos evaluados son eficaces y seguros, se analiza (por diferentes agentes clave) cuál es su lugar dentro de las opciones y alternativas terapéuticas para determinada indicación clínica. Pese a los retos que aún deben abordarse, los IPT son un instrumento de utilidad y contribuyen a un sistema sanitario más sostenible. Quizás otro reto sea conseguir acercarlos a la gente común y corriente, por qué no.
Bibliografía
Agencia Española de Medicamentos y Productos Sanitarios. Cómo se regulan los Medicamentos y Productos Sanitarios en España. Madrid. AEMPS, 2014. Disponible en: https://www.aemps.gob.es/publicaciones/publica/regulacion_med-PS/v2/docs/reg_med-PS-v2-light.pdf (última consulta: 20 de marzo de 2019).
Agencia Española de Medicamentos y Productos Sanitarios. Nota informativa: presentación de la solicitud de código nacional del material de acondicionamiento a través de RAEFAR II para medicamentos autorizados por procedimiento centralizado. Madrid. AEMPS, 2017. Disponible en: https://www.aemps.gob.es/informa/notasInformativas/industria/2017/docs/NI-MUH_08-2017-Raefar-II.pdf (última consulta: 19 de marzo de 2019).
Ministerio de Sanidad, Consumo y Bienestar social. Propuesta
de colaboración para la elaboración de los informes de posicionamiento terapéutico de los medicamentos. Madrid. AEMPS, 2013. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/propuesta-colaboracion-informes-posicionamiento-terapeutico.pdf (última consulta: 10 de marzo de 2019).
Hernández García C, Calleja-Hernández MA, Peiró Moreno S, Gómez-Pajuelo P. Política y evaluación de los medicamentos hospitalarios. Madrid. Fundación Gaspar Casal, 2015. Disponible en: http://fgcasal.org/publicaciones/Libro_Evaluacion_de_Medicamentos_Hospitalarios.pdf (última consulta: 15 de marzo de 2019).
Rodrigues T, Izmirlieva M, Ando G. Analysis of new model of therapeutic positioning reports as A P&R decision-making tool
in Spain. Value Health. 2014; 17(7): A432.
López N, Pomares E, Cuesta M. Analysis of Spanish therapeutic positioning reports published until 2017. Value Health. 2018; 21(3): S154.
Macaulay R, Griffiths EA. Spanish therapeutic positioning reports: a high hurdle that is pointless to overcome? Value Health. 2016; 19(3): A262.
Salvador J, Aparicio J, Barón FJ, García-Campelo R, García-Carbonero R, Lianes P, et al. Equity, barriers and cancer disparities: study of the Spanish Society of Medical Oncology on the access to oncologic drugs in the Spanish Regions. Clin Transl Oncol. 2017; 19(3): 341-356.