En el estudio de AELMHU Situación actual sobre la accesibilidad a los medicamentos huérfanos en España se observa que entre 2002 y 2016 la Agencia Europea del Medicamento (EMA) autorizó 94 medicamentos con designación huérfana todavía vigente, para los que la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) otorgó 77 códigos nacionales (CN), llegándose a comercializar sólo 49 medicamentos huérfanos. Asimismo, los nuevos datos muestran que el tiempo medio transcurrido entre la autorización de la EMA y la comercialización fue de 19,2 meses, y de 12,6 meses desde la obtención del CN-AEMPS a la comercialización.
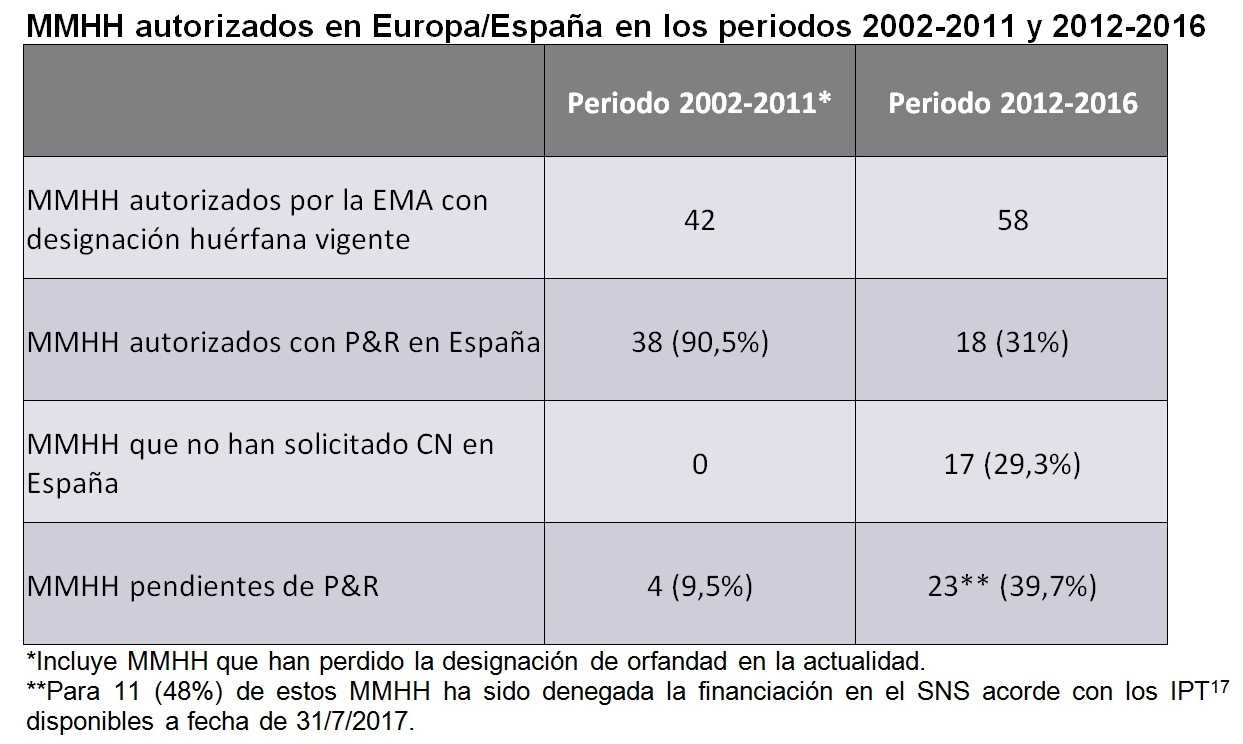
Si se compara, el número de medicamentos huérfanos autorizados con P&R en España versus los MMHH autorizados por la EMA en 2 periodos concretos, el período 2002-2011 y el periodo 2012 a 2016, se observa que dicho número descendió del 90,5% al 31%. En el análisis de los mismos periodos el número de medicamentos huérfanos que seguían en proceso de negociación de precio y reembolso (P&R) se multiplicó por cuatro, pasando del 9,5% al 39,7%.
Comparativa con países europeos
Según los datos presentados por AELMHU, España comercializa un 52% de medicamentos huérfanos menos que la Unión Europea.
De cara al estudio, se han localizado y analizado 16 medicamentos huérfanos no oncológicos no comercializados en España en 2016. De promedio, desde su autorización hasta la obtención del CN transcurrieron 14 meses. De estos 16 medicamentos huérfanos, 12 de ellos (el 75%) son tratamientos para patologías crónicas a largo plazo. En este contexto, considerando 15 de los 16 medicamentos huérfanos analizados, que representan moléculas nuevas, se estima que en total habría como máximo 4.300 pacientes candidatos a recibir alguno de estos tratamientos. De los 16 medicamentos huérfanos analizados, Reino Unido comercializó 13, Italia 6 y Francia 8 medicamentos huérfanos.
Finalmente, se evaluó el impacto económico de la introducción de 13 de estos 16 MMHHs MMHH no oncológicos no comercializados en España, encontrándose que representaría un 0,07% del Gasto Total Sanitario Público y un 0,75% del Gasto Farmacéutico Hospitalario en el primer año tras su comercialización.
Impacto presupuestario
Actualmente, conseguir en España el acceso al mercado de los medicamentos huérfanos no es tarea fácil. A pesar de haber sido aprobados por la Agencia Europea del Medicamento (EMA), la posterior negociación de financiación y precio en España impide a los pacientes afectados por enfermedades raras el acceso equitativo a estos nuevos fármacos.
Por otra parte, y tal como refleja el análisis del impacto económico anteriormente mencionado, a pesar de que el coste individual por paciente de los medicamentos huérfanos puede resultar elevado, el coste global asociado a ellos es muy bajo debido a la baja prevalencia de las enfermedades raras, resultando un bajo impacto en el presupuesto sanitario.
Antecedentes
A comienzos de 2016, AELMHU realizó un estudio sobre el acceso a los medicamentos huérfanos en España, en comparación con los países más relevantes de Europa, que desvelaba un importante descenso en el número de medicamentos huérfanos que han obtenido financiación y precio en los últimos cuatro años, y en el que se ponía de manifiesto un cambio de tendencia que aleja a España de los ratios identificados para otros países europeos, respecto al acceso efectivo a estas innovaciones terapéuticas. En concreto, los datos revelaban ya que, de los 94 nuevos medicamentos huérfanos aprobados por la EMA en el periodo 2002-2015, con designación de medicamento huérfano vigente, en España sólo se comercializaron 51, poco más de la mitad.
El estudio también analizó la situación desde la aprobación del medicamento por parte de la EMA hasta la decisión de financiación y precio, para determinar la comercialización y el acceso efectivo al nuevo medicamento. El análisis excluyó los tratamientos oncológicos y valoraba, entre otros parámetros, el impacto de los medicamentos huérfanos en términos de prevalencia y de impacto presupuestario, comparando la situación en España a la de los principales países europeos (Reino Unido, Italia y Francia). Alemania no se incluye en análisis por contar con un modelo de financiación y comercialización diferente.
Las referencias apuntadas en este análisis se han visto reconfirmadas en los datos actualizados a 31 de diciembre de 2016 presentados ahora por AELMHU.